碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲硅烷(SiH4)的结构与甲烷相似。SiH4分子为________分子(填极性或非极性),SiH4分子中H原子的1s轨道与Si原子的sp3轨道重叠形成Si—H_____ (填“σ键”或“π键”);甲硅烷能与硝酸银发生如下反应:SiH4 + 8AgNO3 + 2H2O=8Ag↓ + SiO2↓ + 8HNO3,该反应中氢元素被氧化,则SiH4充当_______剂(填氧化或还原),由此可判断电负性:Si H(填“>”、“<”或“=”)。
(2)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是___ 填标号)。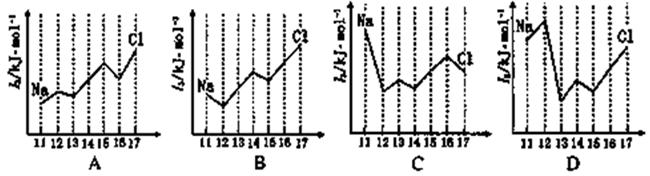 (3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为 。
(3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为 。
②石墨晶体具有层状结构,质软、熔点高、能导电,其导电原理同金属晶体,则其导电的粒子是 (填“阳离子”、“阴离子”或“自由电子”)。
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:。与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为。
(2)PO43-的空间构型是。
(3)与NH3互为等电子体的分子、离子有、(各举一例)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为。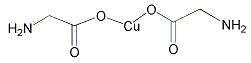
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为。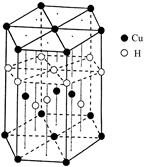
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: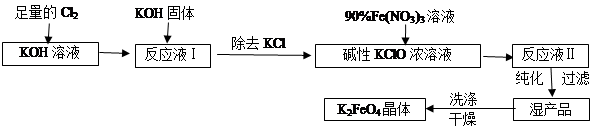
已知:①2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在(填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式;
(3)在“反应液I”中加KOH固体的目的是:
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途。
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是;发生反应的△H0(填“>”、“<”或“=”)。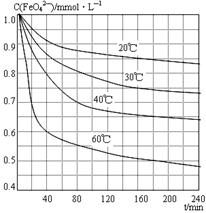
CO是常见的化学物质,有关其性质和应用的研究如下。
(1)有同学认为CO可以被酸性高锰酸钾溶液氧化为CO2,请你设计实验验证该同学的猜想是否正确。请在下列流程图方框内填上所需药品的名称或化学式,从而补齐你的设计,方框不够可以补,也可以不填满。
(2)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。五羰基合铁的制备原理如下:
Fe(s)+5CO(g) Fe(CO)5(g)
Fe(CO)5(g)
①下列说法正确的是。
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g) Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为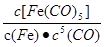 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存 |
②五羰基合铁能与氢氧化钠溶液反应生成Na2Fe(CO)4和另两种常见无机物,该反应的化学方程式为:.
③今将一定量的Fe(CO)5的苯溶液,用紫外线照射片刻。取照射后的溶液完全燃烧,得到30.58gCO2、
5.4gH2O及1.6g红棕色粉末。红棕色粉末的化学式为,照射后的溶液中Fe(CO)5和Fe2 (CO)9的物质的量之比为.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g); △H1
②CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g);△H2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8kJ热量。
①该混合气体中NO和NO2的物质的量之比为
②已知上述热化学方程式中△H1=—1160kJ/mol,则△H2=
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式。
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题: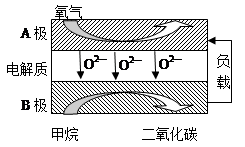
④B极为电池极,电极反应式为
⑤若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为(标况下),实际上消耗的甲烷体积(折算到标况)比理论上大,可能原因为.
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: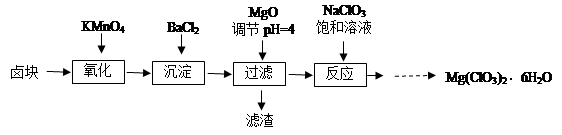
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。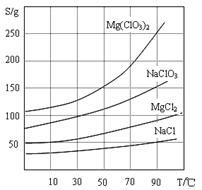
(1)过滤所需要的主要玻璃仪器有,
(2)加入BaCl2的目的是,加MgO后过滤所得滤渣的主要成分为。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;②;③;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:;
②产品中Mg(ClO3)2·6H2O的质量分数为。