在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
(1)带有2个单位正电荷的微粒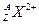 ,质量数A是137,中子数N
,质量数A是137,中子数N
是81,2.74g该微粒所含有的电子约为mol。
(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25% 。
①计算R的相对原子质量为;
②写出R最高价氧化物对应的水化物的化学式.
28.下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据上图回答问题:
(1)C分子中的官能团名称是 ______________;化合物B不能发生的反应是(填字母序号):
a 加成反应 b取代反应 c消去反应 d酯化反应 e水解反应 f 置换反应
(2)反应②的化学方程式是____________。
(3)试分析反应②加热的原因。
Ⅰ、。;
Ⅱ、。。
(4)A的结构简式是 __________________。
(5)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构 Ⅱ.属于非芳香酸酯 Ⅲ.与 FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式。
(6)常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
C物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| m |
0.1 |
0.1 |
pH=9 |
| n |
0.2 |
0.1 |
pH<7 |
从m组情况分析,所得混合溶液中由水电离出的c(OH-)=mol·L-1。
n组混合溶液中离子浓度由大到小的顺序是 ___________。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行: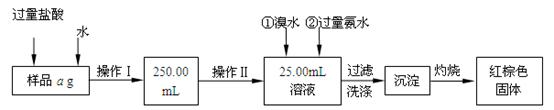
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是
Ⅱ.有同学提出,还可以采用以下方法来测定: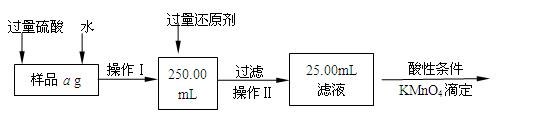
(1)溶解样品改用了硫酸,而不用盐酸,为什么
(2)选择的还原剂是否能用铁(填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 平衡常数 |
Ka=1.8×10-5 |
Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3; PH由小到大的排列顺序是___________________________
(2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
| A.c(H+) | B.c(H+)/ c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/ c(H+) |
E. c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mlPH=2的CH3COOH与一元酸HX,加水稀释过程中PH与溶液体积的关系如图所示,则HX的电离平衡常数_________CH3COOH的电离平衡常数(填大于小于或等于)理由是______________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得PH=6,则溶液中C(CH3COO-)—c(Na+)=____________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=__________
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
e |
I |
| 原子核数 |
单核 |
两核 |
四核 |
| 粒子的电荷数 |
一个单位正电荷 |
一个单位负电荷 |
0 |
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M____________________________________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是________________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)