(6分)随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
①SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l) ΔH=a kJ·mol-1
②2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH=b kJ·mol-1
③2HI(g)=H2(g)+I2(g) ΔH=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH= kJ·mol-1
(2) 已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是: 。
(3)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放 kJ的能量。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+Na+Cu2+Al3+ |
| 阴离子 |
SO42-HCO3-NO3-OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B,D。
(2)将含l mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为________________。
(3)C常用作净水剂,用离子方程式表示其净水原理。
(4)在A溶液中加入过量澄清石灰水,其离子方程式为.
(5)向20mL 2mol/L C溶液中加入60mL E溶液,充分反应后得到0.78g沉淀,则E
溶液的物质的量浓度可能是moI/L。
越来越多的食品问题所造成的危害有目共睹,给我们敲响了警钟。一些“毒奶粉”竟然顶着国家“免检产品”桂冠。某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7. 8倍,长期食用可能致癌。NaNO2有像食盐一样的咸味,能发生如下反应:
2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应中氧化剂是______,若有1.75 mol的还原剂被氧化,则被还原的氧化剂是_______mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋、⑥白酒。进行实验时,必须选用的物质有________。(填编号)
(3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂__________能使NaNO2转化为不引起二次污染的N2。(填编号)
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为____________________________________________。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图: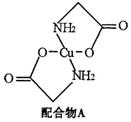
(1)Cu元素基态原子的外围电子排布式为。
(2)元素C、N、O的第一电离能由大到小排列顺序为。
(3)配合物A中碳原子的轨道杂化类型为。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为。
键的数目为。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,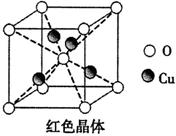
则该化合物的化学式是。
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为。
(4)右图为绿色电源“二甲醚燃料电池”的工作原理示意图。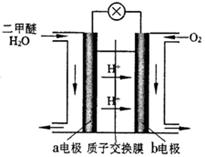
该电池工作时,H+向极移动(填“正”或“负”);a电极的电极反应式为。
某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
(5)物质B可直接用作氮肥,则B的化学式是。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式。