在构成宇宙万物的一百多种元素中,金属约占了80%,它们在现代工业和新材料、新技术研究中具有至关重要的意义。现有a、b、c、d四种金属元素,a是人体内含量最多的金属元素,b是地壳中含量最多的金属元素,c是海水中含量最多的金属元素,d是人类冶炼最多的金属元素。
(1)元素a在元素周期表中的位置为 ;
(2)下列可以证明b、c金属性强弱的是 。
A.最高价氧化物对应水化物的溶解性:b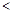 c B.单质与水反应的剧烈程度:b
c B.单质与水反应的剧烈程度:b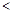 c
c
C.相同条件下,氯化物水溶液的pH值:b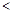 c D.c可以从b的氯化物水溶液中置换出b
c D.c可以从b的氯化物水溶液中置换出b
(3)b的阳离子与Yn-的电子数相同, Y所在族各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是________。(填化学式)
(4)b电池性能优越,b一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
①该电池的总反应化学方程式为_______________________________________________;
②用b电池电解CuSO4溶液(电极均为铂电极),通电一段时间后,一极上析出红色固体,另一极的电极反应式为______________________,此时向溶液中加入8gCuO固体后可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为___________L。
(5)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是 。
A.腐蚀过程中,一定会有气体放出
B.腐蚀过程中,水膜的碱性会增强
C.在酸性条件下,负极的电极反应式为:2H++2e-→H2
D.与电源的负极相连,可以防止发生这种腐蚀
(6)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式: 。
(10分)写出下列反应的化学方程式:
(1)实验室制乙炔。
(2)TNT炸药制取。
(3)苯酚和溴水反应。
(4)乙醛与新制Cu(OH)2反应。
(5)溴乙烷消去反应。
下列有机化合物都含有多个官能团:
(1)能够与 NaOH溶液反应的有_________________。(填入字母编号,下同)
(2)能够与 Na2CO3溶液反应的有_______________________。
(3)能够与 NaHCO3溶液反应的有_______________________。
(8分)按要求写出下列有机物的名称和结构简式: ③石炭酸 ④硬脂酸甘油酯
③石炭酸 ④硬脂酸甘油酯
某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20ml恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值:Z , A 。
(2)X元素在周期表中的位置是第_______周期______族。
(3)把X的单质放入水中,写出反应的化学方程式。
用0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素的中子比质子多一个。则R元素为_________(填元素符号),相对原子质量为__________。