硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5·H2O来制取。
第①步:将硼镁矿用浓碱NaOH溶液溶解,过滤得NaBO2溶液。 第②步:将NaBO2浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O。
第③步:将硼砂溶于水后,用H2SO4调节酸度,过滤得H3BO3晶体。
第④步:加热硼酸使之脱水。
第⑤步:脱水产物用镁还原即得粗单质硼。请回答下列问题:
(1)第①步和第⑤步的化学方程式分别为 , 。
(2)将制得的粗硼在一定条件下反应全部生成BI3,然后BI3热分解可以得到纯净的单质硼。0.20g粗硼制成的BI3分解得到的I2全部被收集后,用 2.00mol/LNa2S2O3溶液滴定,用去27.00mL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。
①盛装Na2S2O3溶液的为 (填“酸式”或“碱式”)滴定管。
滴定过程中所用的指示剂为 ,滴定终点的现象是
②粗硼中硼的含量为 。
(3)上述制得的硼砂晶体(Na2B4O7·10H2O)还可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。巳知纯品过硼酸钠晶体中各元素的物质的量之比为n(Na):n(B):n(H):n(O)=l:1:n:7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如下图所示,则T3时所得晶体的化学式为: 。若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数 (填“升高”、“降低”或“不变”)。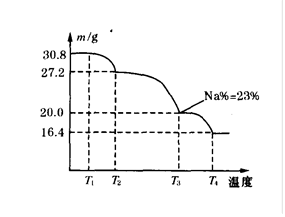
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) 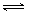 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 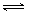 H2NCOONH4(氨基甲酸铵) (l)△H1
H2NCOONH4(氨基甲酸铵) (l)△H1
第二步:H2NCOONH4(l) 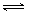 H2O(l)+H2NCONH2(l)△H2
H2O(l)+H2NCONH2(l)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
气体X对氢气的相对密度为22。X可由下列步骤合成(cat表示催化剂):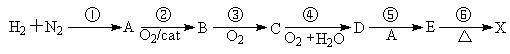
试根据题意回答下列问题:
(1)X的化学式为 ;X与CO2互为等电子体,所以可推测其分子结构呈 (型)。
(2)液态时的A能与金属钠反应生成F,熔融态的F能与X反应,其中生成一种固体G。G在受撞击时,生成两种单质,其中一种单质能与Li在常温下反应。试写出F+X→G的化学反应方程式 。
(3)D在较稀浓度(2mol/L)时能与Mg反应生成X。试写出化学反应方程式 。
(4)实验室制备少量的X,可将B通入K2SO3溶液中制得。请写出该反应的化学方程式 。
(7分)(1)往铜和稀硫酸的混合物中加入双氧水溶液,可以观察到的实验现象是:溶液变蓝,并产生无色气体,请写出涉及这一现象的所有化学反应方程式:
, 。
(2)两个氧化还原反应的离子方程式如下:
① R3++Cl2+6OH-=RO3-+2Cl-+3H2O
② 5RO3-+2Mn2++14H+=5R3++2MnO4-+7H2O
由此 (填“能”或“不能”)得出Cl2的氧化性比MnO4-强的结论,理由是 。
今有两种溶液A、B,共含有较多量的H+、K+、Na+、Mg2+、Fe3+和Cl-、OH-、NO3-、S2-、SO32-十种离子。在两种溶液里所含上述离子各不相同,其中A溶液里含有三种阳离子和两种阴离子,它们是______,其余离子在B溶液里,它们是______。