今有室温下四种溶液,有关叙述不正确的是( )
| |
① |
② |
③ |
④ |
| 浓度c/mol/L |
0.1 |
0.1 |
0.1 |
0.1 |
| 溶液 |
氨水 |
CH3COONa溶液 |
醋酸 |
盐酸 |
A.在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如下图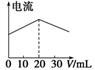
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.用④滴定①,滴定曲线如下图,可用酚酞作指示剂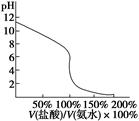
(6分)有一包白色固体,可能含有NaCl、KCl、Na2SO4、BaCl2和Na2CO3中的一种或几种,为探究其成分,某同学做了如下实验:
(1)将此白色固体取样,溶解于水,有白色沉淀生成;
(2)过滤出沉淀,并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成;
(3)向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解。通过上述实验现象分析:该白色固体中一定含有的物质是,一定不含的物质是,不能确定的是。
(1)1.7g NH3共有mol 原子;0.1mol CH4在标准状况下含有的电子数为,体积约为。在同温同压下,同体积的NH3和CH4的质量比为_____________;在同温同压下,同质量的NH3和CH4的体积比为______________。
(2)已知1.2g RSO4中含0.01molR2+,则RSO4的摩尔质量是;R的相对原子质量是。
(3)如图所示是医院为病人输液时用的一瓶质量分数为5%的葡萄糖(其分子式为C6H12O6)注射液标签,则该溶液中含水的质量为;该溶液的密度约为;该溶液的溶质的物质的量浓度为。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
(1)分离饱和食盐水和沙子的混合物;
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)分离水和汽油的混合物;
(4)从碘的水溶液里提取碘;
(5)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C);
(6)可以淡化海水得饮用水。
在“电解饱和食盐水”的实验探究中,将有关实验现象所得结论填入下表。
| 实验现象 |
结论 |
|
| ① |
通电后,铁棒和石墨棒上都有气泡冒出 |
|
| ② |
将阴极上方收集的气体靠近火焰,有爆鸣声 |
|
| ③ |
阳极收集到的气体呈黄绿色,可使湿润的淀粉KI试纸变蓝 |
|
| ④ |
铁棒一端的溶液滴加酚酞后变红 |
电解饱和食盐水的化学方程式为:。
海水中含有丰富的化学资源。食盐是海水中的重要资源,海水在浓缩过程中析出盐的种类和质量如下表(单位g/L):
| 海水密度(g/ml) |
CaSO4 |
NaCl |
MgCl2 |
MgSO4 |
NaBr |
| 1.13 |
0.56 |
||||
| 1.20 |
0.91 |
||||
| 1.21 |
0.05 |
3.26 |
0.004 |
0.008 |
|
| 1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
| 1.26 |
0.01 |
2.64 |
0.022 |
0.02 |
0.04 |
| 1.31 |
1.40 |
0.54 |
0.03 |
0.06 |
(1)现代产盐常用方法从海水中得到食盐。
(2)为了得到含较少杂质的的粗盐,实际生产中卤水的密度控制在范围之内。
(3)由上表可知先析出的物质是。
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入(填“序号”)等试剂,能将上述杂质除去。
a.BaCl2 b.NaOH c.Na2CO3 d.HCl