对于平衡体系mA(g)+nB(g) pC(g)+qD(g) ; ΔH<0。下列结论中不正确的是
pC(g)+qD(g) ; ΔH<0。下列结论中不正确的是
A.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
现有下列几种常见的物质:①N2 ②NaCl ③Ca(OH)2 ④金刚石⑤SiC ⑥NH3⑦NH4Cl ⑧CO2。其中,(以下空格均填写序号)
(1)含有非极性键的分子晶体是;
(2)含有极性键的分子晶体是 ;
;
(3)只含离子键的离子晶体是;
(4)含有极性共价键的原子晶体是;
(5)既含有离子键,又含有极性共价键和配位键的离子晶体是
将一只铝制的易拉罐内充满二氧化碳,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口,经过一段时间后,罐壁凹瘪,又过一段时间后,瘪了的罐壁重新鼓起来。
(1) 罐壁凹瘪的原因是,反应的化学方程式是:
(2) 瘪罐重新鼓起来的原因是;
反应的离子方程式是。
.氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是。
| A.制汽轮机叶片 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,她不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为。
从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。
试回答下列问题:
(1)写出用海滩上的贝克制取Ca(OH)2的化学方程式:
。
(2)写出电解熔融氯化 镁制取镁的化学方程式
镁制取镁的化学方程式 :。
:。
(3)将电解生成的氯气通入氢氧化钠溶液中可得到一种消毒液,写出反应的化学方程式: 。
。
(4)粗盐中常含有Ca2+、Mg2+等杂质,可用Na2CO3、NaOH除去。精制过程发生反应的离子方程式为、。
(5)为有效除去Ca 2+、
2+、 Mg
Mg 2+、SO
2+、SO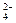 ,加入试剂的合理顺序为
,加入试剂的合理顺序为 (选填a,b,c)
(选填a,b,c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂 ,再加Na2CO3
,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
有机物X是有机合成工业中一种重要的中间体。X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得。合成路径如下图所示: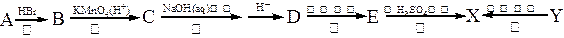 已知:①
已知:①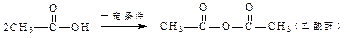
②Y分子中C、H、O(不含其它元素)的个数比为1:1:1,且Y的相对分子质量的范围在80-160之间。
③Y是一种二元酸,且能使Br2/CCl4褪色。
④E和X中都含有五元环。
请回答以下问题:
(1)请指出反应类型:反应②______________,反应⑤_____________。
(2)Y的分子式为_______________;X的结构简式为_______________。
(3)反应①和②的顺序不能调换,请简述理由_________________________________ _。
_。
(4)化合物D在浓H2SO4催化作用下能生成一种高分子化合物,请写出该反应方程式
______________________________________________________。
(5)化合物D有许多同分异构体,其中同分异构体D1和D2都满足以下条件:分子中含有酯基结构,且D1和D2都是二元酸。请写出D1、D2的结构简式:_____________,
_____________。