(选修3-物质结构与性质)(★限选)
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。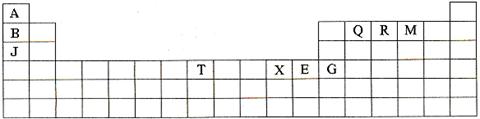
(1)T3+的核外电子排布式是: 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是 (填序号)。
①B单质的熔点高于J单质,是因为B单质的金属键较强 ②J比X活泼,所以J可以在溶液中置换出X ③将J2M2溶于水,要破坏离子键和共价键 ④RA3沸点高于QA4,主要是因为前者相对分子质量较大 ⑤一个Q2A4分子中含有五个σ键和一个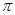 键
键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式: 。
(5)B与R单质直接化合生成一种离子化合物B3R。
该晶体具有类似石墨的层状结构。每层中,B原
子构成平面六边形,每个六边形的中心有一个R
原子。层与层之间还夹杂一定数量的原子。
请问这些夹杂的原子应该是 (填B或R的元素符号)。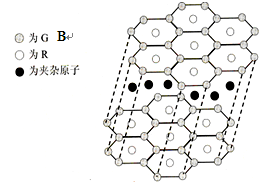
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。但G的第一电离能却明显低于E,原因是 。
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x="______" .Fe(CO)x在一定条件下发生反应:
Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。
(3)写出CO的一种常见等电子体分子的结构式______;两者相比较沸点较高的为______(填化学式).CN-中碳原子杂化轨道类型为 ,S、N、O三元素的第一电离能最大的为 (用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图所示。
①基态铜原子的核外电子排布式为 。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能x100%)
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1) 实验室中制取少量碘可采用如下方法:
KI + CuSO4 → A (白色)↓+ K2SO4 + I2
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式: 。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式: 。
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O  H3O++ OH-),生成的阳离子为 ;阴离子为 。
H3O++ OH-),生成的阳离子为 ;阴离子为 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式: , 。
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为_________mol·L-1(精确到0.01)。
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式: 。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
①在T1、T2温度下,一定量的NH3发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ 3H2(g) 2NH3(g)的△H_______0(填“>”或“<”)。
2NH3(g)的△H_______0(填“>”或“<”)。
②在 温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
(2)利用图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。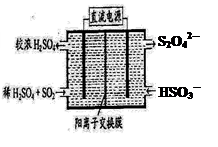
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
请根据化学学科中的基本理论,回答下列问题
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。火法还原CuO可制得Cu2O.已知:1克C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如图1所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为______
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,反应:2H2O(g)⇌2H2(g)+O2(g)△H=+484kJ•mol-1经测定A、B两容器在反应过程中发生如图2所示变化,则A、B两容器反应的温度T1________T2(填“<”、“=”或“>”),该过程中A容器至少需要吸收能量________kJ
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是(填序号)_________.
A.向平衡混合物中充入Ar B.升高反应的温度
C.增大反应体系的压强 D.向平衡混合物中充人O2
(4)25℃时,H2SO3═HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=_________mol/L.