卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
(1)卤族元素位于周期表的_________区;溴的价电子排布式为______________
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是_______
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___
| |
氟 |
氯 |
溴 |
碘 |
铍 |
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(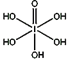 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的分子式__________(写出1个)
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________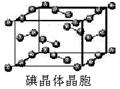
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配 位形 成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________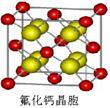
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:
①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g)ΔH =" +206.2" kJ·mol-1
②CH4(g) + CO2(g) =" 2CO(g)" + 2H2(g) ΔH =" +247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:。
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为________________。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为_________________。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
①NaOH标准溶液应盛放在下图所示的滴定管____(选填“甲”或“乙”) 中。
②滴定时所用的指示剂X可为________,判断滴定终点的方法是_________________________。
③下列操作会导致测定结果偏低的是________________
| A.碱式滴定管未润洗 |
| B.锥形瓶用待测液润洗 |
| C.读取标准液读数时,滴定前仰视,滴定到终点后俯视 |
| D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
④滴定实验记录如下表(样品中杂质不与酸或碱反应)。
| 滴定次数 |
待测溶液A的体积(mL) |
消耗0.1000mol·L-1NaOH溶液的体积 |
| 1 |
25.00 |
22.50 |
| 2 |
25.00 |
22.55 |
| 3 |
25.00 |
22.45 |
试计算样品中Na5P3O10的物质的量为__________mol。
现有浓度均为0.1 mol·L-1的下列溶液:①盐酸②醋酸③氢氧化钠④氯化铵⑤硫酸氢铵⑥氨水,请回答下列问题:
(1)已知t ℃时,Kw=1×10-13,则t ℃(填“>”“<”或“=”)____________25 ℃。
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_________。
(3)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)__________________。
(4)常温下,将①和③按体积比2:1混合后,溶液的pH约为_______(已知lg3 = 0.5)。
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4·2H2O)可以降低土壤的碱性。试用化学方程式表示用石膏降低土壤碱性的反应原理________。
(2)习惯上把电解饱和食盐水的工业生产叫做氯碱工业,用化学方程式表示电解饱和食盐水的总反应为________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式,只填一种即可)
(4)通过火法冶金炼出的铜是粗铜,不适于电器及其他许多工业使用,必须进行电解精炼。电解时,用________作阴极,________作阳极。
(1)实验室制取Cl2的反应方程式之一为: 。
。
被氧化的盐酸占反应盐酸总量的,用NA表示阿伏加德罗常数的值,当标准状况下有11.2L氯气生成时,该反应的电子转移数为。
(2)已知下列两个氧化还原反应:O2+4HI 2I2+2H2O 及Na2S+I2══2NaI+S,则三种单质的氧化性顺序由强到弱为:
2I2+2H2O 及Na2S+I2══2NaI+S,则三种单质的氧化性顺序由强到弱为:
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:。
(4)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为:。