依据元素周期表及元素周期律,下列推断中正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的核外电子数 |
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是
| A.将NaHCO3固体加入新制氯水,有无色气泡(H+) |
| B.使红色布条褪色(HCl) |
| C.使淀粉KI试纸变蓝(Cl2) |
| D.滴加AgNO3溶液生成白色沉淀(Cl-) |
下列变化过程中肯定要放出热量的是
| A.H2→H+H | B.H+Cl→HCl |
| C.H2O(l)→H2O(s) | D.CaCO3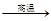 CaO+CO2 CaO+CO2 |
支持固态氨是分子晶体的事实是
| A.氮原子不能形成阳离子 | B.氢离子不能单独存在 |
| C.常温下氨是气态物质 | D.氨极易溶于水 |
相关化学用语表示正确的是
A.NH4Br的电子式: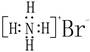 |
B.S的结构示意图: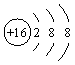 |
| C.次氯酸的结构式:H-Cl-O |
D.原子核内有18个中子的氯原子: |
可以证明某化合物一定含有离子键的性质是
| A.熔融状态能导电 | B.具有较高的熔点 |
| C.可溶于水 | D.溶于水能导电 |