氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中性分子X结合H+形成的,有类似于NH4+的性质。
(1)1个N3-离子含有 个电子;
(2)形成N2H5+离子的中性分子X的分子式是 ;
X在氧气中可以燃烧,写出燃烧反应的化学方程式 ;
(3)写出N2H62+离子在强碱溶液中反应的离子方程式 。
部分中学化学常见元素原子结构及性质如表所示
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A在第三周期中简单离子半径最小 |
| ② |
B |
B原子最外层电子数是内层电子数的1/5 |
| ③ |
C |
C是常用化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
| ⑤ |
E |
E在周期表中可以排在IA族,也可以排在ⅦA族 |
(1)A原子中的电子占有______个轨道,最外层有______种不同运动状态的电子。这五种元素的原子半径由大到小的顺序为_________________(用元素符号表示)。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min- D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程: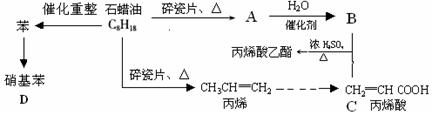
请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团(填名称)
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯:
③苯→硝基苯如何加热?:。其优点是。
(4)目前制备酒精的方法有两种:
方法一: 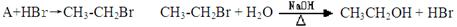
方法二: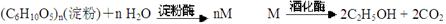
①对方法一所涉及的有机反应类型分别为:,
②对于方法二, M的分子式为:
③下列说法正确的是____________(填代号)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为。
(2)N≡N的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1,计算说明N2中的键比键稳定。(填“σ”或“π”)
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴阳离子组成,熔点低于100 ℃,其挥发性一般比有机溶剂(填“大”或“小”),可用作(填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是,与同一个N3-相连的X+有个。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定