(14分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
已知:H2O(l)=H2O(g) △H=+44kJ·mol—1
CO(g)+H2O(g) CO2(g)+H2(g) △H=—41.2kJ·mol—1
CO2(g)+H2(g) △H=—41.2kJ·mol—1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ |
800 |
1000 |
1200 |
1400 |
| 平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是_____反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。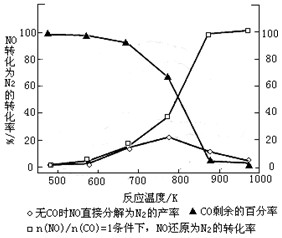
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为 。
下表是元素周期表的一部分,回答下列有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑦ |
⑧ |
|||||
| 3 |
① |
③ |
④ |
⑥ |
⑨ |
⑩ |
||
| 4 |
② |
(1)写出⑦单质分子的化学式;画出负2价的 ⑨离子结构示意图;
写出⑩单质与水反应的离子方程式:。
(2) ①~⑩元素中最高价氧化物的水化物碱性最强的是________(填化学式)。
①、③、④简单阳离子按离子半径由大到小的顺序排列为_________(用离子符号表示)。
(3)写出①、⑧元素按1:1的原子比例组成的化合物与⑤的最高价氧化物反应的化学方程式:。
(4) X元素①~⑩元素中的其一种,其氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应。
则 :X的元素符号是,它位于元素周期表的位置。
X的氢氧化物与盐酸反应的离子方程式。
(5)①与③化学性质较活泼的是_____,(元素符号)设计实验证明:________________________________________________________________________________________________________(简述实验操作步骤及现象)
氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
1、(1)配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
(2)若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
2、已知:4NH3+O2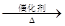 4NO+6NO,4NO+3O2+2H2O
4NO+6NO,4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
(1)a mol NO完全转化为HNO3理论上需要氧气_____________mol。
(2)为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:C+H2O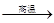 CO↑+H2↑。甲
CO↑+H2↑。甲
酸苯丙酯(F)是生产香料和药物的主要原料。下图是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去)其中D的分子式为C9H10O,且能发生银镜反应。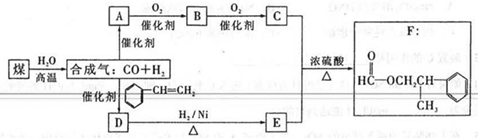
根据上述转化关系回答下列问题:
(1)写出A、D的结构简式:
A:________________________ D:__________________________
(2)D→E的反应类型为_____________,B中的官能团是_____________。
(3)写山检验B中的官能团的试剂及出现的现象。
试剂_____________,现象_______________________________________。
(4)写出C与E反应生成F的化学方程式_______________________________________。
(5) “合成气”( CO、H2)除作合成有机物的原料外,还有其它用途,如_____________(举两例)。
(6)F有多种同分异构体,写出满足下列条件的两种同分异构体的结构简式。
①属于酯类,且能发生银镜反应。②苯环上的一氯取代物只有两种结构。
③分子结构中只有两个甲基。
_______________________________________、_______________________________________
工业上用甲苯生产对羟基苯甲酸乙酯(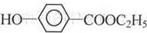 ),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用。其过程如下:
),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用。其过程如下: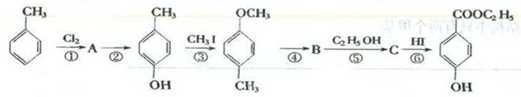
据上图填写下列空白:
(1)有机物A的结构简式_____________,B的结构简式_____________;
(2)反应④属于_____________,反应⑤属于_____________。
(3)③和⑥的目的是_______________________________________;
(4)写出反应⑥的方程式_______________________________________。
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(3)装置C的作用是_____________。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中,50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_____________________________________,写出有关离子方程式:_______________________________________。