丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g) CO2(g)+H2 (g)
CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件 ,第5~6min之间,改变的条件是 。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 。又知397℃时该反应的平衡常数为12,请判断该反应的△H 0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向_ ___极(填“正”或“负”);电池的负极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
【化学—选5:有机化合物基础】
有机物A、D均是重要的有机合成中间体,D被称为佳味醇(chavicol),具有特殊芳香的液体,也可直接作农药使用。下图所示的是由苯酚为原料合成A、D的流程。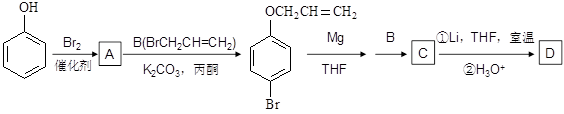
已知:
①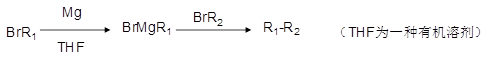
②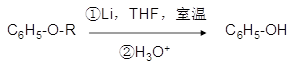
③请回答下列问题:
(1)写出A、C、D的结构简式___________、_____________、_____________。
(2)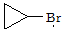 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有_____种氢处于不同的化学环境。
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有_____种氢处于不同的化学环境。
(3)指出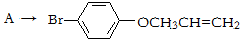 的有机反应类型:________。
的有机反应类型:________。
(4)化合物B经过下列转化,可合成用于制造树脂、合成橡胶乳液的有机原料丙烯酸。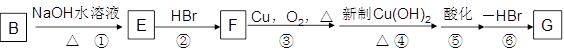
①设置反应②、⑥的目的是__________________________。
②写出反应③的化学反应方程式______________________________________。
③G与甲醇反应生成的酯H是生产丙烯酸树脂的一种重要单体,写出H聚合的化学反应方程式_________________________________。
【化学—选修2:化学与技术】 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题: (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果); (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号) (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。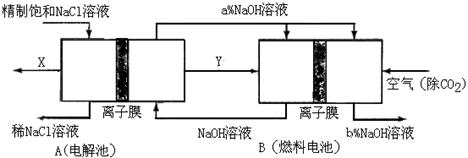
 ①图中X是_____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X是_____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________; ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____; ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
简答题
(1)盐碱地因含较多的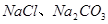 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释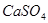 的作用。
的作用。
(2) 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将 与
与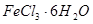 混合并加热,可得到无水
混合并加热,可得到无水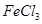 ,得到无水
,得到无水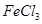 的化学方程式为。
的化学方程式为。
(12分)牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为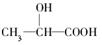 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:________ ______。
(2)一定条件下乳酸能发生的反应类型有____ __ __(填序号)。
| A.水解反应 | B.取代反应 | C.加成反应 | D.中和反应 E.氧化反应 F.酯化反应 |
(3)写出乳酸与碳酸钠溶液反应的化学方程式:____________ _。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式:____
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式:。
(2)实验室进行蒸发浓缩用到的主要仪器有、带铁圈的铁架台、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处;

图1图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体。
| A.缓慢冷却溶液 | B.溶液浓度较高 |
| C.溶质溶解度较小 | D.缓慢蒸发溶剂 |
(5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图2装置进行实验,充分反应后,测得B装置增重3.4g。则该粗产品中含氮的质量分数为。