(本题共8分)工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
32、能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
33、下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
34、要提高CO的转化率,可以采取的措施是________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
35.寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
下图所示物质中,只有X是单质,常温下A和B呈气态,且B是导致酸雨的大气污染物,D是淡黄色固体。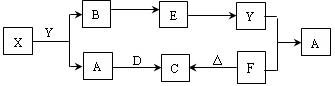
据此回答下列问题:
(1)元素X在元素周期表中位于周期族。
(2)物质D的电子式为,其阴阳离子个数比为。
(3)请列举物质F的两种用途:、。
(4)写出X和Y反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出Y和F反应的离子方程式。
A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:
(1)A、D元素的名称分别为AD。
(2)写出Y水解的离子方程式。
(3)将9g B单质在空气中完全燃烧,将燃烧后的气体缓慢通入1L1 mol·L-1的NaOH溶液中,充分吸收后,最终所得溶液中各离子浓度由大到小的顺序是:
。
(4)在101k Pa时,1gX气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污染的稳定物质,放出18.6KJ的热量,该反应的热化学方程式为:
。
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答下列问题:
(1)Y的最高价氧化物对应水化物的化学式是__________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是____________________。
此液体具有的性质是__________(填字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为__________。
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是________________________________。
自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取纳米级TiO2的流程如下:
(1)Ti的原子序数为22,Ti位于元素周期表中的第________周期,第______族。
(2)步骤①加铁的目的是_________________;步骤②冷却的目的是_______________。
(3)上述制备二氧化钛的过程中,可以利用的副产物是______________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(4)由金红石制备单质钛,涉及到的步骤为:
TiO2 TiCl4
TiCl4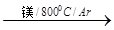 Ti
Ti
已知:①C(s)+O2(g)==CO2(g)△H= -393.5kJ·mol-1
②2CO(g)+O2(g)==2CO2(g)△H= -5665kJ·mol-1
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g)△H= +41kJ·mol-1
则TiO2(s)+ 2Cl2(g)+C(s)==TiCl4(s)+2CO(g)的△H=____________。
反应TiCl4+2Mg == 2MgCl2+Ti 在氩气氛中进行的理由是________________________。
胆矾是一种重要工业用盐,如电镀工业用作全光亮酸性镀铜主盐和铜离子添加剂。印染工业用作媒染剂和精染布的助氧剂。农业上作为杀菌剂。某研究小组拟用废旧铜器(主要杂质为含铁的化合物)来制备胆矾。设计流程如下:
pH值控制可参考下列数据
| 物质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
| 氢氧化铁 |
2.7 |
3.7 |
| 氢氧化亚铁 |
7.6 |
9.6 |
| 氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)试剂A可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4 c.浓FeCl3溶液 d.浓HNO3
(2)第②步加入H2O2溶液发生的反应的离子方程式为:_____________________________。
(3)第③步中所加试剂B为________(填化学式)。调节溶液的pH合适的范围是__________。
(4)操作⑤通常加H2SO4调节pH=1是为了:______________________________________。
(5)本流程中多次用到过滤操作,该操作主要用到的玻璃仪器为: _______________,操作⑥的主要步骤为:、。
(6)某同学认为上述流程中所加的试剂A并不理想,需作改进,其理由是______________
__________________________________________________________。请你帮助提出一条改进方案____________。