(本题共12分)
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。
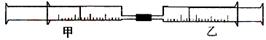
| 实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
| 1 |
40 mL HCl |
40 mLNH3 |
产生白烟 |
| 2 |
40 mL Cl2 |
10mL 水 |
剩余气体为20mL |
| 3 |
30 mL NO |
15 mL O2 |
|
| 4 |
20 mL AlCl3溶液 |
10 mL NaOH溶液 |
生成白色沉淀,后消失 |
41.如果实验1甲针筒内改装30 mL Cl2 ,乙针筒内仍为40 mLNH3,实验时,甲针筒内也有白烟产生。写出有关反应的化学方程式 。
42.由实验2可知,常温常压下氯气在水中的溶解度为 。
43.实验3 反应后甲针筒内气体的体积为 。
44.实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
45.将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。

46.有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
(1)A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
(2)已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。
I、下列物质中属于强电解质的是;属于弱电解质的是;属于非电解质的是。(填序号)①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是Cr2(SO4)3是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为。
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g) +2B(s)
yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压②增大A的浓度③增大C的量
④升温⑤降温⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II. 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。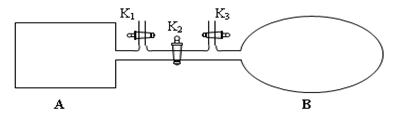
①B中可通过________________判断可逆反应2NO2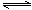 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______(填 “变大”“变小”或“不变”)。
③若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
(14分)下表是元素周期表的一部分。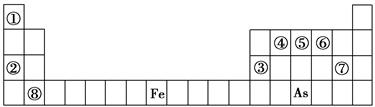
已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):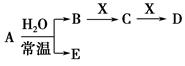
(1)⑧的元素符号是________。
(2)⑤与As两种元素中,非金属性较强的是________(填元素符号)。
(3)若E为氧化物,则A、X的化学式分别为________、________。
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的碱性溶液反应,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子。该反应的离子方程式为________________________________。
(12分) NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓H2SO4 |
(4)请配平以下化学方程式:
Al+NaNO3+NaOH===NaAlO2+N2↑+H2O。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
(5)在微生物的作用下, NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是。
(6分)在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Ag+Mg2+Ba2+ |
| 阴离子 |
NO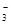 CO CO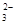 SiO SiO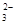 SO SO |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。(相对原子量:Si 28;S 32)
(1)实验Ⅰ能确定一定不存在的离子是________。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”要求写出计算过程)。
| 阴离子 |
NO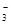 |
CO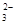 |
SiO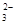 |
SO |
| c/(mol·L-1) |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:____________________,