以食盐为原料进行生产并综合利用的某些过程如图所示.
(1)除去粗盐中的Ca2+、Mg2+和SO42﹣离子,加入下列沉淀剂的顺序是(填序号) .
a.Na2CO3b.NaOHc.BaCl2
(2)将滤液的pH调至酸性除去的离子是 .
(3)如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是 ,在X极附近观察到的现象是 ;Y电极上的电极反应式是 ,检验该电极反应产物的方法是 .电解NaCl溶液的离子方程式是 .
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 .
(5)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH﹣)的比值是 .
。A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1xL B溶液、0.001mol·L-1yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是溶液,判断理由是。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是(填写序号)
① ;②
;② ;
;
③c(H+)和c(OH-)的乘积④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间 |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2)表示的反应速率为(取小数二位,下同)。
②该反应为(填“吸”或“放”)热反应,实验2条件下平衡常数K=。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。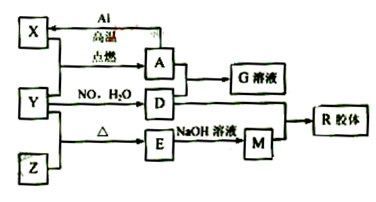 回答下列问题:
回答下列问题:
(1)组成单质X的元素在周期表中的位置是;M中存在的化学键类型为;
(2)一定条件下,Z与H2反应生成ZH4的结构式为。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:。
(4)写出M和D的稀溶液反应生成R的离子方程式:
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。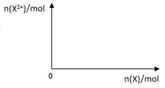
某澄清透明溶液中,可能含有NH4+、Mg2+、Al3+、Fe2+、Br—、SO42—、NO3—、CO32—等离子的一种或几种,进行下列实验: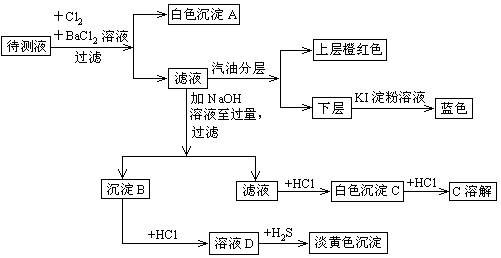
根据实验结果回答:
⑴溶液中肯定有的离子是___________。
⑵判断待测溶液中有无CO32—,并说明理由________________________________。
⑶沉淀B肯定有什么物质___________,生成淡黄色沉淀的离子方程式 ___________。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子气体分子,原子中有三个单电子 |
| X |
核外有5个能级,最高能级上只有1个电子 |
| Y |
最外层电子数是次外层电子数2倍 |
| Z |
最高正价为+7价 |
(1)写出元素Z的离子结构示意图__________。另有某元素M在地壳中的含量仅次于X,写出其+2价阳离子的电子排布式。
(2)X的硫酸盐与过量氢氧化钡反应的离子反应方程式为__________。
(3)COZ2俗称光气,其中碳氧原子之间的共价键有个σ键,个π键
(4)TH3的空间构型为 。(填“难”或“易”)溶于CCl4。