(15分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下:
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验所生成的碘时,主要用到的玻璃仪器有 。
(2)从滤液中得到KIO3成品的操作为 ,操作时除不断用玻璃棒搅拌外,还需要注意的事项有
。
(3)某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;反应的方程式如下,请配平
KIO3+ KI+ H2SO4 ="==" K2SO4+ I2+ H2O;
③生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32- ="==" 2I-+S4O62-。
滴定时,选择 为指示剂,眼睛应该注视 ,达到滴定终点时的现象为 ,加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
 某研究性小组借助
-
的仪器装置完成有关实验
某研究性小组借助
-
的仪器装置完成有关实验


【实验一】收集
气体。
(1)用装置
收集
气体,正确的操作上(填序号)。 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 【实验二】为了探究镀锌薄铁板上的锌的质量分数
和镀层厚度,查询得知锌易溶于碱:
↑据此,截取面积为
的双面镀锌薄铁板试样,剪碎、称得质量为
。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
【实验二】为了探究镀锌薄铁板上的锌的质量分数
和镀层厚度,查询得知锌易溶于碱:
↑据此,截取面积为
的双面镀锌薄铁板试样,剪碎、称得质量为
。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。 (2)选用
和(填仪器标号)两个装置进行实验。
(2)选用
和(填仪器标号)两个装置进行实验。 (3)测得充分反应后生成氢气的体积为
(标准状况),
=。
(3)测得充分反应后生成氢气的体积为
(标准状况),
=。 (4)计算镀层厚度,还需要检索的一个物理量是。
(4)计算镀层厚度,还需要检索的一个物理量是。 (5)若装置
中的恒压分液漏斗改为普通分液漏斗,测量结果将(填"偏大"、"偏小"或"无影响")。
(5)若装置
中的恒压分液漏斗改为普通分液漏斗,测量结果将(填"偏大"、"偏小"或"无影响")。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器
做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为
。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器
做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为
。 (6)
。
(6)
。 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为
的质量)实现探究目标。实验同样使用仪器
。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为
的质量)实现探究目标。实验同样使用仪器
。 (7)从实验误差角度分析,方案丙方案乙(填"优于"、"劣于"或"等同于")。
(7)从实验误差角度分析,方案丙方案乙(填"优于"、"劣于"或"等同于")。
 从铝土矿(主要成分是
,含
、
、
等杂质)中提取两种工艺品的流程如下:
从铝土矿(主要成分是
,含
、
、
等杂质)中提取两种工艺品的流程如下:


请回答下列问题: (1)流程甲加入盐酸后生成
的方程式为.
(1)流程甲加入盐酸后生成
的方程式为. (2)流程乙加入烧碱后生成
的离子方程式为.
(2)流程乙加入烧碱后生成
的离子方程式为. (3)验证滤液
含
,可取少量滤液并加入填试剂名称)。
(3)验证滤液
含
,可取少量滤液并加入填试剂名称)。 (4)滤液
中溶质的主要成份是(填化学式),写出该溶液的一种用途_
(4)滤液
中溶质的主要成份是(填化学式),写出该溶液的一种用途_ (5)已知298
时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.
(5)已知298
时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.
 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略); (1 )从废液中提纯并结晶处
。
(1 )从废液中提纯并结晶处
。 (2)将
溶液与稍过量的
溶液混合,得到含
(2)将
溶液与稍过量的
溶液混合,得到含
 (3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
固体
(3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
固体 (4)煅烧
,得到
固体
(4)煅烧
,得到
固体 已知:
在热水中分解
已知:
在热水中分解 (1)中,加足量的铁屑出去废液中的
,该反应的离子方程式是。
(1)中,加足量的铁屑出去废液中的
,该反应的离子方程式是。
(2)中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用。
 (3 )中,生成
的离子方程式是。若
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(3 )中,生成
的离子方程式是。若
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
 (4)中,通过检验
来判断沉淀是否洗涤干净。检验
操作是是。
(4)中,通过检验
来判断沉淀是否洗涤干净。检验
操作是是。
(5)已知煅烧 的化学方程式是 ,现煅烧464.0 的 ,得到316.8 产品,若产品中杂质只有 ,则该产品中 的质量是 (摩尔质量/ ; )
 某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将
氧化成
,而稀硝酸不能氧化
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将
氧化成
,而稀硝酸不能氧化
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

 可选药品:浓硝酸、3
稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
可选药品:浓硝酸、3
稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳 已知:氢氧化钠溶液不与
反应,能与
反应
已知:氢氧化钠溶液不与
反应,能与
反应
 (1)实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
 (2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后 (3)装置①中发生反应的化学方程式是
(3)装置①中发生反应的化学方程式是 (4)装置②的作用是,发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是 (5)该小组得出的结论一局的试验现象是
(5)该小组得出的结论一局的试验现象是 (6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) a.加热该绿色溶液,观察颜色变化
a.加热该绿色溶液,观察颜色变化 b.加水稀释绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化 c.向该绿色溶液中通入氮气,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化 d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题: ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ; ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号): (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
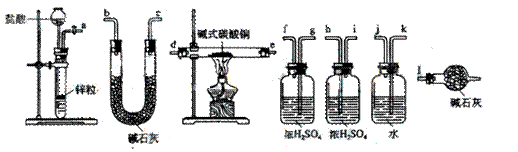 |







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ; (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。