 某研究性小组借助-的仪器装置完成有关实验
某研究性小组借助-的仪器装置完成有关实验



【实验一】收集气体。
(1)用装置收集气体,正确的操作上
 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
 【实验二】为了探究镀锌薄铁板上的锌的质量分数和镀层厚度,查询得知锌易溶于碱:↑据此,截取面积为的双面镀锌薄铁板试样,剪碎、称得质量为。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
【实验二】为了探究镀锌薄铁板上的锌的质量分数和镀层厚度,查询得知锌易溶于碱:↑据此,截取面积为的双面镀锌薄铁板试样,剪碎、称得质量为。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
 (2)选用和
(2)选用和
 (3)测得充分反应后生成氢气的体积为(标准状况),=
(3)测得充分反应后生成氢气的体积为(标准状况),=
 (4)计算镀层厚度,还需要检索的一个物理量是
(4)计算镀层厚度,还需要检索的一个物理量是
 (5)若装置中的恒压分液漏斗改为普通分液漏斗,测量结果将
(5)若装置中的恒压分液漏斗改为普通分液漏斗,测量结果将
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为。
 (6)
(6)
 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为的质量)实现探究目标。实验同样使用仪器。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为的质量)实现探究目标。实验同样使用仪器。
 (7)从实验误差角度分析,方案丙
(7)从实验误差角度分析,方案丙
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到。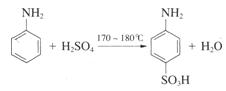
实验室可利用下图实验装置合成对氨基苯磺酸。实验步骤如下: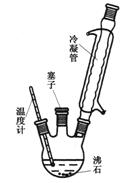
①在一个250 mL三颈烧瓶中加入10 mL苯 胺及几粒沸石,
胺及几粒沸石,
将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5 h。
③ 将反应液冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④ 将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干。(说明:100 mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可溶解6.67 g。)
试回答填空。
(1)装置中冷凝管的作用是▲。
(2)步骤②中采用油浴加热,下列说法正确的是▲(填序号)。
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是▲。
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先▲,
然后▲,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是。每次抽滤后均应将母液收集起来,进行适当处理,其目的是▲。
四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这种材料并进行检测。
Ⅰ.制备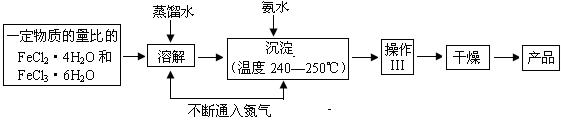
(1)溶解、沉淀操作中不断通入氮气有两个作用:①是通过在反应过程中通 入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;②▲。
入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;②▲。
(2)操作Ⅲ的名称是________▲___。
Ⅱ.产品检测
一、定性检测:产品中铁元素价态检测
试剂主要有:3mol/L硫酸、0.1mol/L氢氧化钠溶液、20%硫氰化钾溶液、0.01mol/L酸性高锰酸钾溶液、氯水(其它用品任选)
(3)请选用上述试剂完成下表
| 步骤 |
操作 |
现象、结论 |
| 1 |
▲ |
 |
| 2 |
取少量产品于试管中加适量步骤1处理好溶液溶解,配成溶液 |
固体溶解,溶液呈浅黄色 |
| 3 |
取少量步骤2配好溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 |
▲ ,产品含有Fe3+ |
| 4 |
▲ |
▲,产品含有Fe2+ |
二、定量测定:
称取23.2g样品于烧杯中,加入加热煮沸后的稀硫酸充分溶解,并不断加热、搅拌,待固体完全溶解后,向所得溶液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。取滤液体积的1/10用浓度为0.200 mol·L-1的酸性KMnO4 滴定,至终点时消耗KMnO4溶液体积29.80mL。
滴定,至终点时消耗KMnO4溶液体积29.80mL。
(4)产品中Fe3+和Fe2+的物质的量之比为 ▲。
III.结果讨论
(5)产品中Fe3+和Fe2+的物质的量之比略大于2:1的可能原因是 ▲。
具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1)草酸(H2C2O4)分解的化学方程式为:,
下列装置中,可用于草酸分解制取气体的是。(填字母)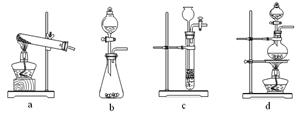
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答: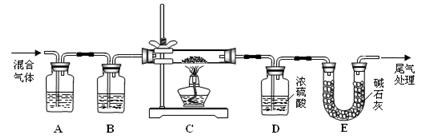
① 为得 到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是、。
到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是、。
② 在点燃酒精灯之前应进行的操作是:(a);(b)通入混合气体一段时间。
③准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应)。
④在本实验中,下列情况会使测定结果n偏大的是(填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
①请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂的用量可选择0.5g、0g)
| 实验 编号 |
实验目的 |
T/K |
催化剂用量/g |
C/mol·l-1:] |
|
| KMnO4 |
H2C2O4 |
||||
| ① |
为以下实验作参考 |
298 |
0.5 |
0.01 |
0.1 |
| ② |
探究KMnO4酸性溶液的浓度对该反应速率的影响 |
298 |
0.5 |
0.001 |
0.1 |
| ③ |
323 |
0.5 |
0.01 |
0.1 |
|
| ④ |
探究催化剂对反应速率的影响 |
0.1 |
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案。
(12分)某同学对丙醛的银镜反应进行了研究:
I .配制银氨溶液:
.配制银氨溶液:
(1)配制银氨溶液时,把氨水滴入硝酸银溶液的操作关键是:
(2)配制银氨溶液过程中涉及的离子方程式为
II.探究银镜反应的最佳实验条件(部分实验数据如下表):
| 实验变量 实验序号 |
银氨溶液 的量/mL |
乙醛的量/滴 |
水浴温度/0C |
反应混合液 的pH |
出现银镜 的时间/min |
| 1 |
1 |
3 |
65 |
11 |
5 |
| 2 |
1 |
3 |
45 |
11 |
6.5 |
| 3 |
1 |
5 |
65 |
11 |
4 |
| 4 |
1 |
3 |
30 |
11 |
9 |
| 5 |
1 |
3 |
50 |
11 |
6 |
| 6 |
1 |
5 |
80 |
11 |
3 |
(3)若只进行实验1 和实验3,其探究目的是
和实验3,其探究目的是
(4)当银氨溶液的量为1 mL,乙醛的用量为3滴,水浴温度为 400C,反应混合液pH为11时,出现银镜的时间范围应该是
400C,反应混合液pH为11时,出现银镜的时间范围应该是
(5)若还要探究银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
(4分)下列实验操作不正确的是(填字母代号)。
A.在催化剂存在的条件下,苯和溴水发生反应可 生成无色、比水重的液体溴苯。 生成无色、比水重的液体溴苯。 |
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛 的实验。 的实验。 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。 |
D.试管中先加入一定量浓硫酸,再依次加入冰醋酸、无水乙醇 ,然后加热制取乙酸乙酯。 ,然后加热制取乙酸乙酯。 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集600C~1500C馏分得到汽油。