用9mol/L的浓硫酸稀释成 0.9mol/L的稀硫酸 100mL ,回答下列问题:
(1)配制操作可分解成如下几步,以下正确的操作顺序是_____________________
A 向容量瓶中注入少量蒸馏水,检查是否漏水
B 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C 用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D 根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(2)如果实验室用98%的浓硫酸(密度为1.8g·cm-3 ) 配制3. 6 mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为_____________mL。
(3)由于错误操作, 使得到的浓度数据比正确的偏大的是___________(填写序号)。
A 使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C 容量瓶用蒸馏水洗净,没有烘干
D 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
[化学——选修3:物质结构与性质]A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中  键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A-I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为____(写一种即可).该阴离子空间构型为____。
(3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____.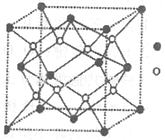
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为 ;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。
运用化学反应原理分析解答以下问题
(1)250℃时,以镍合金为催化剂,向4L容器中通人6 mol CO2、6 molCH4,发生如下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=___________.
②若再向容器中同时充入2.0molCO2、6.0 molCH4、4.0 molCO和8.0 molH2,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
已知:①NO2(g)+SO2(g) SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
②2SO2(g)+O2(g)  2SO3(g)ΔH= —196.6KJ·mol-1
2SO3(g)ΔH= —196.6KJ·mol-1
①写出NO和O2反应生成NO2的热化学方程式__________。
②一定温度下,向2L恒容密闭容器中充人NO2和SO2各1 mol,5min达到平衡,此时容器中NO和NO2的浓度之比为3:1,则NO2的平衡转化率是_________。
(3)常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3.H2O。
①有人称溶液①是油污的“清道夫”,原因是_________(用离子方程式解释)
②上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_______。
③向④中加入少量氯化铵固体,此时c(NH4+)/ c(OH-)的值_________(填“增大”“减小”或“不变”)。
④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
⑤将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________。
[化学——选修3:物质结构与性质]W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是___________________________。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
硼及其化合物在耐髙温合金工业、催化剂制造、髙能燃料等方面应用广泛。
(1)氮化硼是一种耐高温材料,巳知相关反应的热化学方程式如下:
2B(s)+N2(g)=" 2BN(s)" ΔH="a" kJ • mol-1
B2H6 (g)="2B(s)" + 3H2 (g) ΔH ="b" kJ • mol-1
N2 (g) + 3H2 (g)  2NH3 (g)ΔH ="c" kJ• mol-1
2NH3 (g)ΔH ="c" kJ• mol-1
①反应B2H6(g)+2NH3(g)="2BN(s)" +6H2(g)ΔH = (用含a、b、c 的代数式表示)kJ ·mol-1。
②B2H6是一种髙能燃料,写出其与Cl2反应生成两种氯化物的化学方程式: 。
(2)硼的一些化合物的独特性质日益受到人们的关注。
①最近美国化学家杰西·萨巴蒂尼发现由碳化硼制作的绿色焰火比传统焰火(硝酸钡)更安全,碳化硼中硼的质量分数为78. 6%,则碳化硼的化学式为 。
②近年来人们将LiBH4和LiNH2球磨化合可形成新的化合物 Li3BN2H8和Li4BN3 H10,Li3BN2H8球磨是按物质的量之比n(LiNH2) : n(LiBH4) =" 2" : 1加热球磨形成的,反应过程中的X衍射图谱如图所示。
Li3BN2H8在大于250℃时分解的化学方程式为 ,Li3BN2H8与Li4BN3H10的物质的量相同时,充分分解,放出等量的H2,Li4BN3 H10分解时还会产生固体Li2NH和另一种气体,该气体是 。
(3)直接硼氢化物燃料电池的原理如图,负极的电极反应式为 。电池总反应的离子方程式为 。
[化学——选修3:物质结构与性质]冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:
2Al(OH)3 + 12HF+ 3A = 2Na3AlF6 + 3CO2↑+ 9H2O
(1)熔融晶体A时需要破坏的作用力是 ,冰晶石中的配位体是 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为 ,该分子的空间构型为 。
(3)反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小 ,写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种) 、 。
(4)某种A1-Fe合金的晶胞如图所示,该合金的化学式为 。
若晶胞的边长为a nm,则合金的密度为 g • cm-3。