五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
A、B两种有机物均是有机合成的中间体,其中A的分子式为C4H7O2Br,B分子中含2个氧原子,其燃烧产物n(CO2) : n(H2O)=2:1, B的相对分子质量为188。A和B存在如下转化关系: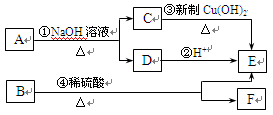
已知:①一个碳原子上连有两个羟基时,易发生下列转化: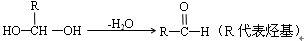
②同一个碳原子上连有两个双键的结构不稳定。
请回答:
(1)A的结构简式是。
(2)B的化学式是。
(3)写出下列反应的化学方程式
反应①;
反应③。
(4)F具有如下特点:①具有弱酸性;②可以形成五种一氯代物,其中苯环上只有两种;④除苯环外,不含有其他环状结构。写出符合上述条件且具有稳定结构的任意两种同分异构体的结构简式:、。
Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向方向移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
(1)图中共有两条曲线X和Y,其中曲线表示NO2浓度随时间的变化;
a、b、c、d四个点中,表示化学反应处于平衡状态的点是。
下列不能说明该反应已达到平衡状态的是。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
(2)前10min内用NO2表示的化学反应速率v(NO2)=。
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是(用文字表达);
(4)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
下表是元素周期表的一部分,A、B、C、D、E、X、Y是表中给出元素组成的常见单质或化合物。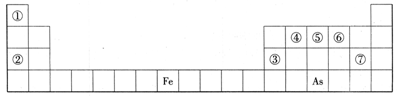
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为单质气体,D为白色沉淀, C与X反应的离子方程式为。
(2)若E为氧化物,则A的化学式为,A与水反应的化学方程式为。
①当X是显碱性的盐溶液,C分子中有22个电子时,则C的电子式为,表示X呈碱性的离子方程式为。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为。
小康同学用一定量的Na2O2与水反应,制取中学一种常见气体。
(1)相关反应的化学方程式是__________________________________,检验反应生成气体的方法是。
(2)利用本实验所得到的溶液(经检测为400 mL 1.0 mol/ L的碱溶液),小康又进行了两个自己感兴趣的实验。
①取100 mL 该溶液用于氯气的尾气吸收,则最多可吸收标准状况下的氯气多少升?(请写出相关反应的方程式或关系式,并列式计算,下同)
②取100 mL 该溶液恰好能与10 g某镁铝合金恰好完全反应,请计算该合金中铝的质量分数。
下列框图所示的转化关系中,A、B、C、D、E都是常见元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。通常情况下L是无色液体。反应①和②均在溶液中进行。
请按要求问答下列问题:
(1)写出下列物质的化学式:F、K。
(2)若反应①在溶液中进行,其离子方程式为。
(3)实验室制取I的化学方程式为。
(4)向J溶液中滴入NaOH溶液时,现象为,用化学方程式解释该变化过程。