氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为 ;
(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如右图所示。X的元素符号是______,X离子与N3-形成的化合物化学式为______。
(3)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
A B C D E
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(共8分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。 
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+0.5O2(g)=H2O(g) △H=-241.8 kJ/mol;该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________________。
Ⅰ (本题4分)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合物加热有以下反应发生:2Cu2O+Cu2S 6Cu+SO2↑; 填写下列空白:
6Cu+SO2↑; 填写下列空白:
①在该反应中,氧化剂是。还原剂是。
②氧化产物与还原产物的质量比是。
Ⅱ(本题7分)A、B、C、D、E为易溶化合物,其离子组成为
| 阳离子 |
Fe3+、Ba2+、Al3+、Na+、Ag+ |
| 阴离子 |
NO3—、OH—、SO42—、Cl—、CO32— |
在各化合物中离子不重复,分别取其溶液进行实验,结果如下:
①在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失;
②用pH试纸测得B和C溶液显碱性,0.1mol/L的C溶液pH小于13;
③在D溶液中加入铁粉,溶液质量增加且无气体产生;
④在E溶液中加入过量B,没有沉淀产生。
完成下列填空:
(1)A的化学式为;(2)③反应的离子方程式为;
(3)检验D溶液中阴离子的的方法是;
(4)E的的化学式为,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)。
已知化合物A的分子式为C4H6O2,不溶于水,并可以发生如下图所示的变化: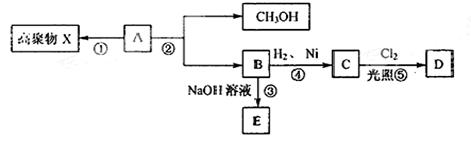
已知:C物质的一氯代物D只有两种同分异构体。请回答:
(1)A分子中含有的官能团的名称。
(2)①②④⑤反应中属于取代反应的有(填序号)。
(3)写出②的反应方程式。
(4)写出一种下列要求的物质的同分异构体的结构简式
①C的同分异构体中属于酯且能发生银镜反应
②C的同分异构体中属于醇且能发生银镜反应。
(5)简述验证D中含有氯元素的方法
。
(6)17.2gB与足量的碳酸氢钠溶液反应,标准状况下生成二氧化碳的体积为L。
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿(主要成分是二氧化锰)制高锰酸钾的流程如下(部分条件和产物省略):
请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:。
(3)从经济性考虑试剂X宜选择(填名称):。上述流程中,设计步骤IV和V的目的是。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为。
②电解过程中,阴极附近电解质溶液的pH将(填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式:。
(6)已知:常温下, 。工业上,调节pH沉淀废水中Mn2+.当pH=10时,溶液中c(Mn2+)=。
。工业上,调节pH沉淀废水中Mn2+.当pH=10时,溶液中c(Mn2+)=。
碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为,可能发生副反应有。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为。
(3)向75 mL 4 mol•L-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。①写出该反应的离子方程式:。(只用一个离子方程式表示)
②该吸收溶液中离子浓度大小排序为。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=—571.6kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = —90.8kJ•mol-1
CH3OH(g) △H3 = —90.8kJ•mol-1
计算甲醇蒸气的燃烧热 =。
=。
(5)某温度下,发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 
①向某容器中充入1.0 molH2和1.0 molCO2(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
| 0 |
5 min |
10 min |
15 min |
20 min |
25 min |
|
| I(800℃) |
1.0 |
0.80 |
0.70 |
0.65 |
0.50 |
0.50 |
| II(800℃) |
1.0 |
0.7 |
0.60 |
0.50 |
0.50 |
0.50 |
相对实验I,实验II可能改变的条件可能是,该温度下,平衡常数=。
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应。
下列图像正确且说明可逆反应达到平衡状态的是。(填序号)