二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: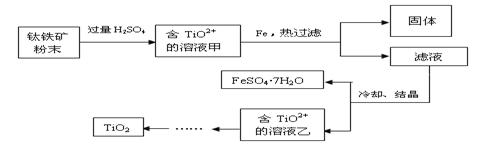
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下: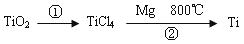
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
某有机物A分子式为CxHyOz,15gA完全燃烧生成22gCO2和9gH2O。
(1)求该有机物的最简式
(2)若A是一种无色具有强烈刺激气味的气体,具有还原性,则其结构简式是_____________。
(3)若A和Na2CO3混合有气体放出,和醇发生酯化反应,则A的结构简式为:_________。
(4)若A是易挥发有水果香味的液体,能发生水解的反应,则其结构简式为:___________。
(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
I、已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是。
a.c(H+)·c(OH-)=1×10―14 b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol/L
⑶已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq)△H>0。
Ca2+(aq)+A2-(aq)△H>0。
①温度降低时,Ksp(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)。
II、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,作如下处理:
Cr2O72-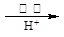 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
⑷欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入g FeSO4·7H2O。
⑸若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下: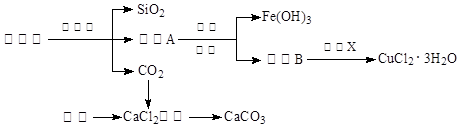
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 |
pH (开始沉淀) |
pH(完全沉淀) |
| Fe(OH)3 |
1.9 |
3.2 |
| Fe(OH)2 |
7.0 |
9.0 |
| Cu(OH)2 |
4.7 |
6.7 |
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至(填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是。
⑵操作X包括、、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①操作c中量取盐酸体积的仪器是。
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将(选填“偏大”、“偏小”或“无影响”)。
③若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为。
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为mol·L-1。(2)等体积的下列溶液中,阳离子的总物质的量最大的是。(填序号)。
① 0.2 mol·L-1的CuSO4溶液② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺。(填序号)。
①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4
(4) 水的电离平衡如图所示:
①若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从增加到。
②100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是。
一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为,x=;
②若反应经2min达到平衡,平衡时C的浓度0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件(可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入molA气体molB气体。