(7分)现有7瓶失去标签的液体,已知它们是有机试剂,可能是:①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液。现通过如下实验步骤来确定各试剂瓶中所装的液体:
| 实验步骤和方法 |
实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 |
只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 |
只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新制Cu(OH)2悬浊液并加热 |
只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 |
只有C仍有分层现象,且在D的试管中闻 到特殊香味 |
(1)试给它们的试剂瓶重新贴上标签,其中:
A____________, C____________, E________,F___________,G________。
(2)写出D与NaOH溶液的化学反应方程式: ____________________________
植物精油具有抗菌消炎、解热镇痛等药物功效。从樟科植物枝叶中提取的精油中含有甲、乙、丙三种成分。
Ⅰ.甲经下列过程可转化为乙
(1)反应①的反应类型为。
(2)乙的结构简式为,1mol乙最多可与mol H2反应。
Ⅱ通过下列合成路线由乙可得到丙(部分反应产物略去)
已知下列信息: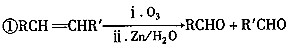
②丙的分子式为C16H14O2,能与溴水、NaOH溶液反应。
(3)A的名称是。B→C的反应条件为。
(4)乙与新制Cu(OH)2反应的化学方程式为。
写出同时符合下列要求的D的同分异构体的结构简式:。
属于二取代苯
b.分子中有5种不同化学环境的氢原子,其个数之比为1:2:2:1:2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑。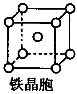
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_______________。
(3)与N3-互为等电子体的分子为__________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型为_____________。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为_________________。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:_____________________________。
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是__________________。
(6)安全气囊的设计原理为6NaN3+Fe2O3 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①氮分子中σ键和π键数目之比为________________________。
②铁晶体中存在的化学键类型为__________________________。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为___________(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。
Ⅰ已知在常温常压下:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②H2O(l)═H2O(g)△H=+44.0kJ•mol-1写出表示甲醇燃烧热的热化学方程式:。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g) 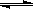 CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断⑴中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH) = 3v逆(H2) ②混合气体的密度不变 ③混合气体的平均相对分子质量不变④CH3OH、H2O、CO2、H2的浓度都不再发生变化⑤CO2和H2的浓度之比为1:3
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。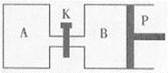
Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题: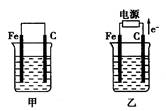
(1)若两池中均盛放CuSO4溶液
①甲池中石墨棒上的电极反应式为____________________.
②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则其电解后的pH为(忽略溶液体积的变化)。
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为g。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是(填写序号)。
a蒸馏;b灼烧;c过滤;d冷却结晶;e蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。
下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
HCN |
H2S |
| Ka/mol•L-1 |
1×10-2 |
6.3×10-4 |
4.9×10-10 |
K1=9.1×10−8 K2=1.1×10−12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为。
苹果酸广泛存在于苹果等水果的果肉中,是一种常用的食品添加剂。经测定,苹果酸的相对分子质量为134,所含各元素的质量分数为:
 ,其中存在5种不同化学环境的H原子。1mol苹果酸能与2molNaHCO3完全反应、能与足量的Na反应生成1.5molH2的。用乙烯为原料人工合成苹果酸的线路如下:
,其中存在5种不同化学环境的H原子。1mol苹果酸能与2molNaHCO3完全反应、能与足量的Na反应生成1.5molH2的。用乙烯为原料人工合成苹果酸的线路如下:
已知:
请回答下列问题:
(1)苹果酸的分子式为_______ 。A物质的名称为_______。
(2)F中含有的官能团名称是_______ 。G+B→H的反应类型是_______。
(3)在合成线路中,C→D这一步骤反应的目的是_____。
(4)D→E反应的化学方程式为_________.
(5)苹果酸和NaHCO3完全反应的化学方程式为________。
(6)与苹果酸含有相同种类和数县的官能团的同分异构体的结构简式为_______。