(1)通过实验事实的验证与讨论,认识苯的结构式。提出问题:苯分子结构是碳碳单双键交替的环状结构吗?
①提出假设:从苯的分子式看,C6H6具有不饱和性;从苯的凯库勒结构式看,分子中含有碳碳双键,但实验验证:苯不能使 褪色;
②经科学测定,苯分子里6个碳原子之间的键 (相同或不同);6个碳原子和6个氢原子都在同一平面上。
③应用:为了表示苯分子的结构特点,可用 来表示苯分子的结构式,而凯库勒式表示苯分子结构式是不确切的,只是人们沿用至今。
(2)乙醇的分子式 ,电子式 ,结构简式 ,官能团为 ,官能团名称是
Ⅰ.图甲是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示): 。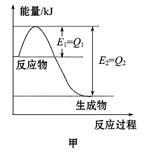
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ·mol-1,
2NH3(g)ΔH="-92.4" kJ·mol-1,
2H2(g)+O2(g)====2H2O(l)ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH= ;
4NH3(g)+3O2(g)ΔH= ;
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO。两步反应的能量变化示意图如下: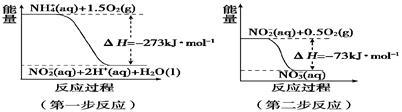
①第一步反应是________反应(填“放热”或“吸热”),判断依据是______________________________________。
②1 mol NH4+ (aq) 全部氧化成NO3-(aq)的热化学方程式是__ ________。
结合下表回答下列问题(均为25℃时的数据)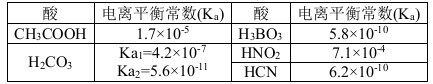
(1)上述五种酸中,酸性最强的是 (填化学式)。HCO3-的电离平衡常数表达式K= 。
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+ OH-= B(OH)4-, 则硼酸为 元酸,硼酸的电离方程式为 。
(3)常温下,0.01 mol·L-1的HNO2溶液加水稀释的过程中,下列各项数据增大的是 (填代号)。
①c(H+ ) ②c (NO2- )/ c(H+) ③Ka(HNO2)
④c(H+ )/ c(HNO2) ⑤c(OH -) ⑥
(4)右图描述的是醋酸与HNO2在水中的电离度与浓度关系,其中反映醋酸的是曲线 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数) 。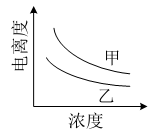
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是 (填代号)。
| A.H2CO3、HCO3-、 CH3COO-、CN- | B.HCO3-、 CH3COOH、CN-、CO32— |
| C.HCN、 HCO3-、CN-、CO32— | D.HCN、 HCO3-、CH3COO-、CN- |
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作)。
某学生欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量。其实验过程如图所示: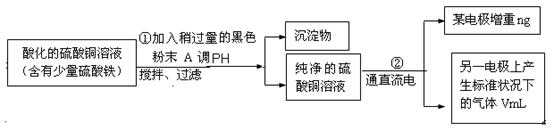
(1)步骤①所加的A的化学式为 ;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则加入A调pH范围是_____ ___ (已知lg2=0.3)
(2)步骤②中所用的部分仪器如右图:则A应接在直流电源的 极(填“正”或“负” )。
(3)石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行 |
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
(6)若②用甲醇—O2—熔融碳酸盐电池提供电能,写出该电池负极的电极反应式
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号)。
A.v(C)=2v(B)
B.容器内压强保持不变
C.v逆(A)=2v正(B)
D.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= 。
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a 变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
在一固定容积的密闭容器中,保持一定条件进行以下反应:X(g)+2Y(g) 3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
(1)在相同实验条件下,若在同一容器中改为加入4molX和6molY,达到平衡后,Z的物质的量为 mol。
(2)在相同实验条件下,若在同一容器中改为加入3molX和2molY,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加 molY, mol Z,才能使平衡时Z为0.6amol。