NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于_________(填以下项目的编号)。
| A.破坏 臭氧层 | B.高温下能使一些金属被氧化 | C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚
硝酸根离子在酸性水溶液中反应的离子方程
式___________________________________________.
(3)在常温下,把NO气体压缩到100大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力大的2/3? __________________________.
(5)NO成为“臭名昭著的明星分子”所包含的哲学原理是
___________________________
对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编号 |
改变的条件 |
化学反应速率 |
| ① |
降低温度 |
|
| ② |
增大O2的浓度 |
|
| ③ |
使用V2O5作催化 剂 剂 |
|
| ④ |
压缩体积 |
(3)在下列物质中:①碘②烧碱③NaCl④干冰⑤氯化氢⑥Na2O2。用序号填写下列空白:
(1)既含有离子键又含有非极性键的化合物是;
(2)仅含有离子键的化合物是;
(3)仅含有共价键的单质是。
下列反应属于放热反应的是_ _;属于吸热反应的是____ __
| A.锌粒与稀H2SO4反应制取H2 | B.氢气在氧气中燃烧 |
| C.碳酸钙高温分解成氧化钙和二氧化碳 | D.氢氧化钾和硫酸中和 |
E.Ba(OH)2·8H2O与NH4Cl反应F. C与CO2高温生成CO
G.葡萄糖在人体内氧化分解 H.钢铁制品生锈的反应
(14分)以下几种物质是常用香精的主要成分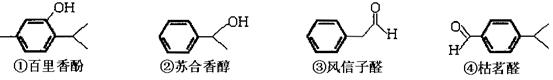 请回答下列问题:
请回答下列问题:
(1)百里香酚和苏合香醇都能发生的有机反应类型有:(填序号)
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤缩聚反应
(2) 写出风信子醛与新制氢氧化铜反应的化学方程式_______________________________________________;
(3)己知醛在一定条件下可以两分子加成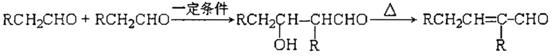
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛合成兔耳草醛的路线如下: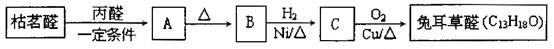
①写出A的结构简式
②设计实验方案检验有机物B中的无氧官能团
③写出C→兔耳草醛的化学方程式
④符合下列条件的A的同分异构体有种。
i.苯环上有两个取代基,其中一个取代基为-CH(CH3)2
ii.能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应。
写出符合上述条件,且核磁共振谱显示有6种氢的结构简式。
Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。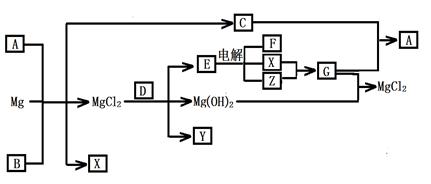
(1)写出下列物质的化学式
AY
(2)写出C的电子式
(3)写出MgCl2与D反应的化学方程式
(4)请用水解平衡理论解释A+B+Mg→C+X+ MgCl2的原因_______________________。
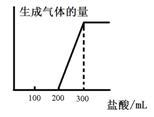
(5)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的 关系如下图所示:则原F溶液的浓度为mol/L。
关系如下图所示:则原F溶液的浓度为mol/L。