(1)分析如图所示的四个装置,回答下列问题: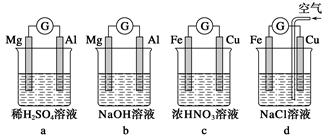
①装置a和b中铝电极上的电极反应式分别为________________、________________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为____________。
(2)观察如下图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为___________________、____ ____________。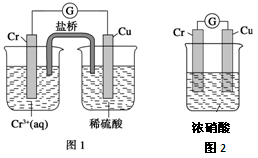
柳胺酚是一种药物,其常用的合成路线如下。回答下列问题:

已知:
(1)柳胺酚的化学式为。
(2)A → B反应所需的试剂是; B→ C反应的化学方程式为。
(3)D→E反应的有机反应类型是;物质E含有官能团的名称是。
(4)E和F反应的化学方程式为。
(5)写出同时符合下列条件的F的同分异构体的结构简式:。
①含有苯环;②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;④苯环上有二种不同化学环境的氢原子。
前四周期原子序数依次增大的元素A,B,C,D中, A是电负性最大的元素,并且A-和B+的电子数相差为8;C和D原子序数相差为2,且都与B位于同一周期,C元素的次外层电子数是最外层电子数的7倍。
回答下列问题:
(1)D的价层电子排布式为_______。
(2)请用电子式表示A、B两元素形成化合物的过程。。
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位数是_ __。
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是、,反射炉内生成炉渣的主要成分是;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是、;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极(填图中的字母);在电极d上发生的电极反应式为;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为。
Ⅰ.甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是(填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= (mol·L-1·min-1) (mol·L-1·min-1) |
| B.该反应在T1时的平衡常数比T2时的大 |
| C.该反应为吸热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为
Ⅱ.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11。某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为。
下图是一些重要工业生产的转化关系(反应条件略去):
请完成下列问题:
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则:
①此反应的化学方程式是。
②D单质的一种重要用途是。
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
①当有1molC生成时,该反应转移电子的总数是。
②将C通入足量的酸性KMnO4溶液中,发生反应的离子方程式为。
(3)若B是一种碱性气体,D为化合物,则:
①该反应的化学方程式是。
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为;有人提出产物Cu中可能还含有Cu2O。已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O。请写出发生反应的化学方程式:_________。