煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
请回答下列同题:
(1)该反应的化学平衡常数表达式K = 。
(2)上述正反应是________反应(填“放热”或“吸热”)。
(3)能判断该反应已经达到化学平衡状态的是____。
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)已知在一定温度下:
C(s)+CO2(g)  2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;
C(s)+H2O(g)  CO(g)+H2(g) 平衡常数K2;
CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K;
H2(g)+CO2(g) 平衡常数K;
则K1、K2 、K之间的关系是________。
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: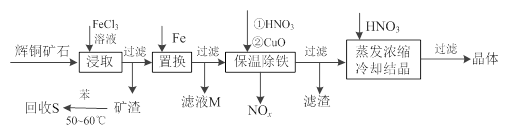
(1)写出浸取过程中Cu2S溶解的离子方程式。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是、。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为;向滤液M中加入(或通入)下列(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式。K4[Fe(CN)6] 中Fe2+与CN-两种离子之间的作用力是。
(2)CN-中碳原子的杂化方式为;1molCN-中含有π键的数目为。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为。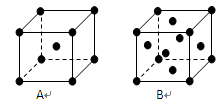
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为。
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:①CH4 (g) +H2O (g) =CO (g)+3H2 (g)△H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g)△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g)△H2=-35.4 kJ·mol-1
③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g)△H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为(填序号),其原因是。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO△H<0
[Cu(NH3)3]Ac·CO△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① O<V≤44.8 L时,电池总反应方程式为;
② 44.8 L<V≤89.6 L时,负极电极反应为;
③ V="67.2" L时,溶液中离子浓度大小关系为。
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下: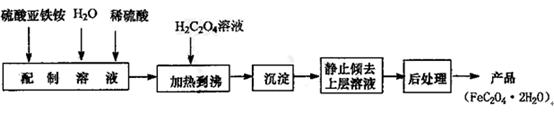
⑴配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是。
6H2O溶液时,需加少量稀硫酸,目的是。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。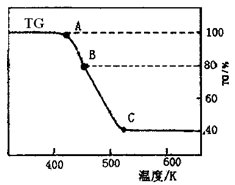
①则C处时残留物的化学式为。
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)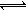 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题: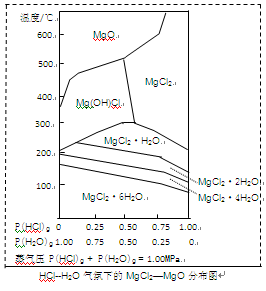
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是;若要得到无水MgCl2须采取的措施是。
5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下: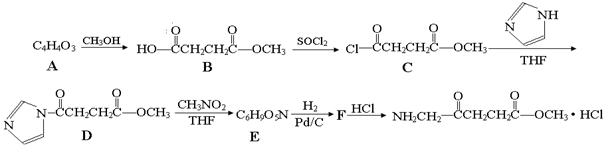
已知: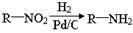
(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为。
(2)5—氨基酮戊酸盐中含氧官能团的名称是,C→D的反应类型为。
(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式。
(4)写出D→E的反应方程式。
(5)已知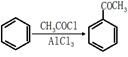 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、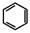 为原料合成
为原料合成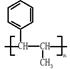 单体的合成路线流程图(无机试剂任选)。
单体的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下: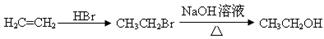
。