(14分)
I.氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下侧能量变化示意图,请写出NO2和CO反应的热化学方程式 。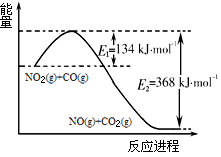
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+ 3H2(g) 2NH3(g) ΔH <0,其平衡常数K与温度T的关系如下表:
2NH3(g) ΔH <0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K= ;
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
II. 如图a,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态: 2 A(?)+B(?) x C(g) ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
x C(g) ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。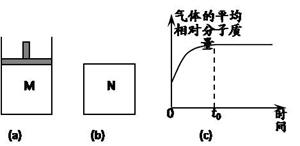
(3)据题中数据计算,x =_____、y =_____;
(4)如图b,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图c(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入一种A、B的状态与z、y的大小之间可能的关系(仿照情形①):
| 可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
|
| A |
B |
||
| ① |
是 |
不是 |
z = y |
| ② |
|
|
|
| |
|
|
|
在100℃和200kPa的条件下,反应aA(g) bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
| 压强(kPa) |
200 |
500 |
1000 |
| B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡移动(填“正向”或“逆向”或“不”),理由是。
(2)压强从500kPa增加到1000kPa时,平衡移动(填“正向”或“逆向”或“不”),其原因可能为。
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到 联氨(N2H4)。
联氨(N2H4)。
(1)写出上述反应的化学方程式:________ __________
(2)联氨是一种可燃性液体,可用作火箭燃料。已知32.0g N2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是:
____________________________________________
(3)联氨的水溶液显弱碱性,用离子方程式表示其显弱碱性的原因:
_______________________________________________
(4)联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。联氨—空气燃料电池放电生成N2和H2O,其电极反应式是:正极________________________;负极_____________________。
下表是A、B、C、D、E五种有机物的有关信息;
 根据表中信息回答下列问题:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做;写出在一定条件下,A生成高分子化合物的化学反应方程式_______。
(2) A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3) B具有的性质是(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:。
(4) E反应能生成(C3H4O2)n的物质,该反应类型为 ;工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10
;工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10
 %,其目的是。
%,其目的是。
(5) 写出由C氧化生成D的化学反应方程式:。
(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
①A分子中的官能团名称是____________;
②A只有一种一氯取代物B,写出由A转化为B的化学方程式:________________________________________________________________________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,F的结构简式是
______________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)____________________。
①加成反应 ②氧化 反应 ③加聚反应 ④水解反应
反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到分子式为C10H12O2Na2的化合物。
“TBHQ”的结构简式是____________________。
(12分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________________________;
(3)写出0.1  的
的 溶液中离子浓度大小排序________________;
溶液中离子浓度大小排序________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为