现有等体积的Ba(OH)2、KOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是( )
| A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则KOH溶液pH最大 |
| B.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3 |
| C.若混合前三种溶液物质的量浓度相等,混合后恰好完全中和,则V1>V2>V3 |
| D.若混合前三种溶液pH相等,混合后恰好完全中和,则V1>V2>V3 |
关于如图所示装置的叙述正确的是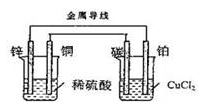
| A.电流由锌经导线流向铂,电子由铜经导线流向碳棒 |
| B.碳棒是正极,铜片是阳极 |
| C.锌片的质量逐渐减少,铂片的质量逐渐增加 |
| D.锌片上发生还原反应,碳棒上发生氧化反应 |
用铂惰性电极进行电解,下列说法正确的是
| A.电解饱和的食盐水,阳极产物是氢氧化钠和氯气 |
| B.电解饱和的氯化钠溶液,在阴极析出钠 |
| C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| D.电解熔融的氯化钠,在阴极上和阳极上析出产物的物质的量之比为2:1 |
、N2H2是一种高效清洁的火箭燃料。0.25 mol N2H2(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式正确的是
| A.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="+133.5" kJ·mol-1 |
| B.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="-133.5" kJ·mol-1 |
| C.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="+534" kJ·mol-1 |
| D.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="-534" kJ·mol-1 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是
| A.①④ | B.③④ | C.①②③ | D.②③ |
设C+CO2 = 2CO(正反应吸热),反应速率为v1;N2+3H2 =2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.v1增加,v2减小 | D.v1减小,v2增大 |