(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: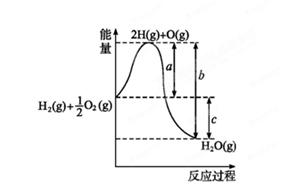
①试写出a、b、c分别代表的意义:
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+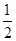 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
H2(g)==H2(l) ΔH="-0.92" kJ·mol-1
O2(g)==O2(l) ΔH="-6.84" kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
(1)完成并配平白磷和氯酸溶液反应的化学方程式:
P4 + HClO3 + → HCl + H3PO4
(2)白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是,若有1.1 mol P4反应,则有mol电子转移;
(3)磷的一种化合物叫亚磷酸(H3PO3)。
已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;
⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;
③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是。
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |
A为两种固体的混合物,G和I为溶液D的组成成分,E为红褐色沉淀,J为淡黄色固体。反应所加的试剂均足量。
(1)混合物A一定含有的元素为(写元素符号);
(2)溶液F一定含有的阴离子为(写离子符号);
(3)写出B+G―→J的化学方程式:
写出溶液C―→溶液D的离子方程式:;
(4)I溶液I中溶质的阳离子常作净水剂,其作用原理是(用离子方程式表示):
。
(8分)有一无色透明澄清溶液,可能含有较大量的Cu2+、Ba2+、SO、NO、
I-、S2-、H+、K+等离子中两种或多种,做如下实验:
①取溶液少量加入铁粉有气体放出;
②另取原溶液加Na2SO3溶液后有气体放出,也有白色沉淀生成,再加盐酸沉淀不完全消失;
③另取原溶液加入AgNO3溶液无沉淀生成。
(1)由此判断原溶液中一定含有的离子是,一定不含有的离子是,可能含有的离子是;
(2)有关反应①的离子方程式为。
已知:①MnO4— +e- MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件)
②MnO4—+ 8H+ + 5e- Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)
(1)在KOH溶液中,KMnO4与K2SO3溶液发生反应, 写出反应的离子方程式。
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式.
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,MnO4‑具有氧化性,最合适的亚铁盐是(选填编号),可用来酸化KMnO4溶液的试剂是(选填编号)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 盐酸 f. 硝酸
(4)向20 mL浓度为0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4‑全部转化为Mn2+ ,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于mL
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO 、SO42-、CO32-,六种化合物的阴阳离子均不相同,且均易溶于水。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
、SO42-、CO32-,六种化合物的阴阳离子均不相同,且均易溶于水。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
写出下列六种化合物的化学式:
A、B、C、D、E、F。