分有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液;
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。试判断:
固体混合物中肯定有________,肯定没有________,可能有________,对可能有的物质,可采用滤液中滴加________溶液方法来检验。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是 16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(80%) Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
【注:80%H2SO4具有浓硫酸的特性】
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~D装置中选择最合适的装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是___________、_____________、_____________。
(2)在实验中“加热催化剂”与“滴加浓硫酸”的操作,首先应采取的操作是___________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法。
①原因__________________________________________________.
验证方法________________________________________________.
②原因__________________________________________________.
验证方法________________________________________________.
(4)将足量SO2通入含1.0mol次氯酸的溶液中,有1.204×1024个电子转移,生成两种强酸,该反应的化学方程式为______________________________。
(5)用25.2gNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间将反应产生的SO2全部排出,测得装置Ⅲ增重了3.2g,则SO2的转化率为__________。
已知丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的紫罗兰酮,如:
下图是合成有机物A的路线图,反应条件和一些不必列出的产物等均已删去。
(1)⑥中官能团的名称是。
(2)写出结构简式②⑤⑥。
(3)写出化学方程式①→②,反应类型;
⑤→⑥,反应类型。
(4)⑤的某种同分异构体符合下列条件,写出所有可能的结构简式。
a.无支链 b.能发生银镜反应 c.核磁共振氢谱有四组吸收峰
(1 5分)
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满状态,且核外的未成对电子只有一个。回答下列问题:
(1)X能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数为;在熔点最高的两种单质中,X的杂化方式分别为、。
(2)X、Y分别与H形成的化学键的极性关系为X—HY —H,键能关系为
—H,键能关系为
X—H__Y—H(填“<” 、“>”或“=”)。
、“>”或“=”)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第电离能。
(4)短周期元素中有一种元素与Z元素位于不同周期的相邻主族,且性质与Z十分相似,由该元素形成的单质属于 晶体。
晶体。
(5)W的价电子排布图为;W的基态原子有种形状不同的原子轨道,W基态原子有种形状不同的原子轨道;W单质中W原子的配位数为;下图表示的是W晶体中微粒的堆积方式(填甲、乙或丙);工业冶炼W的单质有两种常见方法,写出火法炼W的化学方程式。
(6)向W的硫酸盐溶液中逐滴滴加氨水至过量,最终形成的化合物中含、键(填化学键类型,任写两种即可)。
甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,CO与H2反应可制得甲醇:CO+2H2 CH3OH
CH3OH
图1表示该反应进行过程中的能量变化;
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为10min后,容器内的压强变为原来的倍;改变下列条件,能提高CO转化率的是。
CH3OH(g)的平衡常数为10min后,容器内的压强变为原来的倍;改变下列条件,能提高CO转化率的是。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/L的HCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH中加NaOH。
①当溶液中离子浓度关系满足c(HCOO-)<c(Na+)时,则反应的情况可能为;
A.NaOH不足,HCOOH剩余 B.HCOOH与NaOH恰好完全反应
C.NaOH过量
②若加入过量的NaOH,在加入NaOH的过程中,H2O的电离程度如何变?。
下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)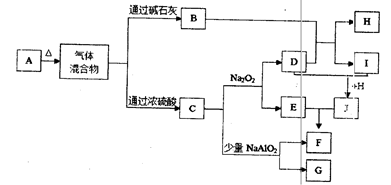
(1)若A加热后得到等物质的量的B和C,则A的化学式为。
(2)实验室检验B的方法是。
(3)写出上述由I生成J的化学方程式。
(4)写出C和少量NaAlO2溶液反应的离子方程式。
(5)由H所含的两种元素组成的18电子微粒的电子式为。
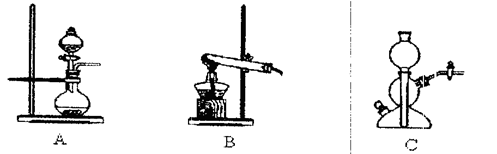
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择(填代号);
A.石灰石B.稀HNO3C.稀H2SO4D.稀HCl E.纯碱
所需气体发生装置是(填代号);所选装置中涉及到的玻璃仪器的名称为。