)(1)2KClO3=2KCl+3O2↑ 是氧化剂, 是还原剂; 元素被氧化, 元素被还原; 是氧化产物, 是还原产物;并用双线桥法标出这个反应的电子转移方向和数目。
2KClO3=2KCl+3O2↑
(2)已知反应:
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
②Cl2+SO2+2H2O=H2SO4+2HCl
1)两反应中的氧化剂的氧化性强弱顺序为 ;
2)反应②中氧化剂与还原剂的物质的量之比为 ;
3)反应①的离子方程式 ;
4)用174kg MnO2通过①②两反应可以处理SO2的质量为 。
某化学小组用下图装置电解CuCl2溶液制少量漂白液: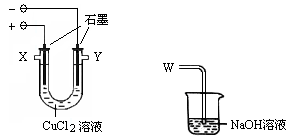
(1)其阳极的反应式是:;导气管W端应与出气口连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
| 物质名称及化学式 |
氯化亚铜CuCl |
碱式氯化铜Cu2(OH)3Cl |
| 性质 |
白色固体、不溶水 |
绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有Cu或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,进行实验。
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是,无水硫酸铜的作用是;
②d中反应的离子方程式是;
③装置b中发生反应的化学方程式是。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为。
⑤阴极上产生白色物质的物质的量是;若装置b冷却时不继续通H2,则计算所得CuCl的产率会(偏大、偏小、不变)。
(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g)△H="―92.4" kJ·mol-1。
2NH3(g)△H="―92.4" kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q184.8 kJ(填“>”、“<”或“=”)。
②已知:
1mol N—H键断裂吸收的能量为kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)=mol·L-1·min-1,该温度下反应的平衡常数K =。欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。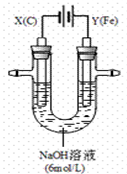
① 电解过程中,X极区溶液的pH(填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-="=" FeO42-+4H2O和。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为。
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)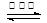 2CO2(g)+N2(g) ΔH =" a" kJ·mol-1
2CO2(g)+N2(g) ΔH =" a" kJ·mol-1
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
| 时间 (s) |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/10-4mol/L |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)/10-3mol/L |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是_______反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率υ(N2)=______________,t1℃时该反应的平衡常数K=____________。
(3)t1℃时向一恒压容器中冲入1molNO和1molCO,达到平衡时测得NO的物质的量为0.2mol,则此时容器的体积V=" ________" L。
(4)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是_____。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(14分)W、X、Y、Z是元素周期表中前四周期的元素,它们的原子序数依次增加。请结合下表中的信息,回答下列问题
| W |
基态原子核外有三个能级,p能级电子处在半充满状态 |
| X |
是所有元素中电负性最大的元素 |
| Y |
气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z |
原子序数为22,被称为“未来金属” |
(1)Z位于元素周期表第_______族;该元素的基态原子价电子排布式为_____________。
(2)W与其同周期相邻的元素的第一电离能由大到小的顺序为________(填元素符号);X、Y两种元素与氢元素形成的共价键键能较大的是___________(请用元素符号表示)。
(3)X的气态氢化物的沸点在同族元素形成的气态氢化物中最_______(填“高”或“低”);已知WX3是微电子工业中优良的等离子刻蚀气体,沸点:129℃,其固态时的晶体类型为________,WX3在潮湿的空气中能与水蒸气发生氧化还原反应,反应生成的无色气体遇到空气变为红棕色,写出该反应的化学方程________。
(4)工业上制取Z的方法是:
第一步,在高温时,将金红石(ZO2)、炭粉混合并通人Y2制得ZY4和一种可燃性气体,已知(下列除Z、Y外其他都为实际元素符号)
①ZO2(s)+2Y(g)=ZY4(1)+O2(g) △H=-410.0kJ·mol-1
②CO(g)=C(s)+1/2O2(g) △H="+110.5" kJ·mol-1
则书写上述反应的热化学方程式是_________________________________________。
第二步,在氩气做保护气的环境中,用过量的金属镁在加热条件下与ZY4反应制得金属Z。
物质结构与性质下表为元素周期表的一部分。请回答下列问题:
(1)上述元素中,属于s区的是(填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图。
(3)元素的第一电离能:③④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为;该分子为分子(选填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为。
(5)元素⑥的单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为,该晶体的密度为(用字母表示)。