分物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)_________ ___________________________。
(3) 某温度时,0.01mol/L的NaOH溶液pH=11,则该温度__________25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH为_________。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__________(填“酸性”、“碱性”或“中性”),溶液中c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(5)若物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈___(填“酸性”、“碱性”或“中性”),醋酸体积____氢氧化钠溶液体积(填“>”、“<”或“=”)。
(6)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
(16分)根据要求回答下列问题:
(1)硝酸钠、75%的酒精溶液、Fe(OH)3胶体、豆浆这些物质能与Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)归为一类的是 。
(2)下列仪器:容量瓶、蒸馏烧瓶、漏斗、分液漏斗,其中不能用于物质分离的是 。
(3)四大基本反应中,一定没有发生电子转移的是 。
(4)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤
C 萃取 D 蒸馏
E 蒸发结晶 F 高温分解
①分离CCl4和H2O: ;
②除去澄清石灰水中悬浮的CaCO3: ;
③除去CaO固体中少量的CaCO3固体: ;
④从碘水中提取碘: ;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物: 。
(一)向一容积不变的密闭容器中充入一定量A和B,发生如下反应: x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: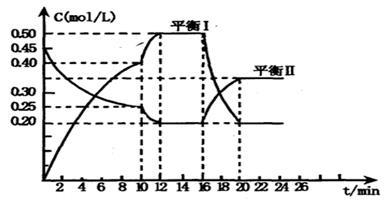
(1)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(2)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(3)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 __________ K2(填“>”“=”或“<”)
(二) 尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s) 关于上述反应的平衡状态下列说法正确的是________________
NH2COONH4(s) 关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO表示的反应速率_____________。
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是_____________(填字母序号)。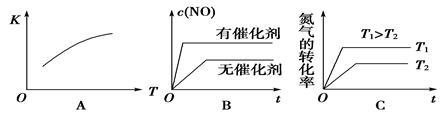
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数___________。(填“变大”、“变小”或“不变”)
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____________________。
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是: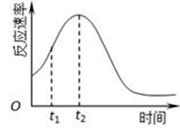
① ;② 。
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
(2)已知:2NO2(g)  N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是(选填字母)_____________。
A B C
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):___________________________。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。 已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为 ;