将一块镁铝合金投入1 mol· L-1的盐酸中,待合金完全溶解后,往溶液中加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图I所示。下列说法中不正确的是
| A.a的取值范围为0≤a<50 |
B. 的最大值为2.5 的最大值为2.5 |
| C.若将关系图改为图II,则a的取值范围为80<a<90 |
| D.若将关系图改为图III,则a的取值范围为75<a<90 |
① CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
③ CO(g)+H2O(g) CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
请回答下列问题:
⑴ 在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内, v(H2)=▲ ;10 min时,改变的外界条件可能是▲ 。

⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。
⑶ 反应③中ΔH3=▲ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应③中正、逆反应速率的关系式是▲ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
A.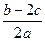 |
B.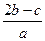 |
C. |
D. |

产。下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
| A.将5.00 mL 12 mol/L的盐酸稀释至500 mL,配制成0.1200 mol/L的盐酸 |
| B.酸碱中和滴定前,滴定管用待装液体润洗而锥形瓶没有用待装液体润洗 |
| C.向浓氨水中加生石灰,将产生的气体通过碱石灰后得到干燥纯净的氨气 |
| D.向FeCl3浓溶液中滴加NaOH溶液,加热至沸腾,制备Fe(OH)3胶体 |
| A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| B.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O |
| C.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O |
| D.硅酸钠溶液中通入过量二氧化碳: SiO32-+CO2+H2O=H2SiO3↓+CO32- |