(13分)某研究小组用下列装置探究SO2与酸性Fe(NO3)3溶液的反应。
请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学: 在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是 ,
证明该观点应进一步确认生成的新物质,其实验操作及现象是 (假设B中试剂完全反应)。
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相
同条件下进行实验。应选择的试剂是(填序号) 。
a.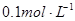 稀硝酸
稀硝酸
b.  溶液
溶液
C.  盐酸等体积混合的溶液
盐酸等体积混合的溶液
I.实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号):.
①500mL量筒②烧杯③1000mL容量瓶④500mL容量瓶⑤天平⑥胶头滴管⑦锥形瓶⑧玻璃棒⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是。
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。 |
| B.烧杯内的稀硫酸未冷却至室温就转移至容量瓶中 |
| C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。 |
| D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。 |
II. 某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: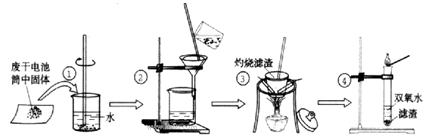
普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
⑴.操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为(填化学式);
(2)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:(答案写在答题卷上)
| 实验目的 |
操作 |
实验现象 |
结论 |
| 1.检验Cl— |
取少许滤液于试管中,加入 |
产生白色沉淀 |
含有Cl— |
| 2.检验NH4+ |
取少许滤液于试管中,加入 |
 |
含有NH4+ |
| 3.检验Zn2+ |
取少许滤液于试管中,加入稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:
(1)装置中试管B的作用是。
(2)实验中可观察到石英管A中的现象为。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验: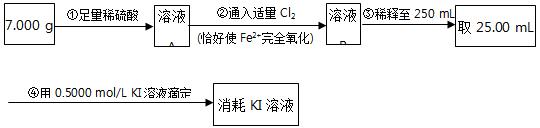
(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、。
(ii)下列有关步骤④的操作中说法正确的是。
a.滴定管用蒸馏水洗涤后可以直接装液
b.锥形瓶不需要用待测夜润洗
c.滴定过程中,眼睛注视滴定管中液面变化
d.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: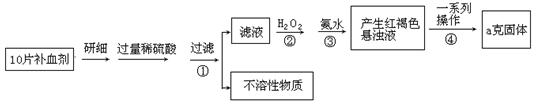
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是。
(2)写出②中的离子反应方程式:。
(3)步骤③中反应的离子方程式:。
(4)步骤④中一系列处理的操作步骤:过滤、、灼烧、冷却、称量。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需。
②滴定到终点时的颜色为色。
(6)正常人每天应补充16.8mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含mgFeSO4·7H2O片剂。
海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料氯化钠时,设计了以下操作流程: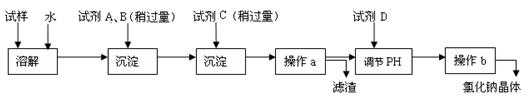
请回答以下问题:
(1)在所提供的试剂中选择:试剂C是
①Na2CO3②BaCl2③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、、三脚架和玻璃棒。
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接,接;B接,接。
(4)写出通入C后,烧杯中所发生的离子反应方程式
(5)电解氯化钠溶液时的离子方程式为
若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况)。将U形管内的溶液混合均匀,其pH约为_______ 。(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)
(6)若想准确读取所得氢气的体积,应采取的操作有
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。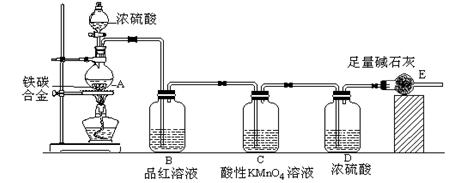
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 。
⑶B中的现象是: ;C的作用是: 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。