(12分)化合物X由元素A、B组成,可用于制造高性能的现代通讯材料—光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料。
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是 。A可由X与焦炭在高温下反应制得,其反应的化学方程式为 。
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液。X与纯碱高温熔融能发生反应的原因是 ;M与Z的水溶液能发生反应的原因是 。要将纯碱高温熔化,下列坩埚中不可选用的是 。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应。一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体。则Y的化学式是 。
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是 。
资源综合利用既符合绿色化学理念,也是经济可持续发展的有效途径。一种难溶的废弃矿渣杂卤石,其主要成分可表示为: ,已知它在水溶液中存在如下平衡:
,已知它在水溶液中存在如下平衡:
为了充分利用钾资源,一种溶浸杂卤石制备K2S04工艺流程如下:
(1)操作①名称是
(2)用化学平衡移动原理解释:Ca(OH)2溶液能溶解出杂卤石中K十的原因:
(3)除杂质环节,为了除去Ca2+,可先加人 溶液,经搅拌等操作后,过滤,再向滤液中滴加稀H2 S04,调节溶液pH至 ;(填“酸性”、“中性”或“碱性”)
(4)操作②的步骤包括(填操作过程):、 、过滤、洗涤、干燥;
(5)有人用可溶性碳酸盐为溶浸剂,其浸溶原理可表示为:
则常温下该反应的平衡常数K=
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设①该反应的气体产物是CO2;②该反应的气体产物是CO。
③该反应的气体产物是 。
(2)设计方案,如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: 。
(6)实验优化学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: 。
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如下: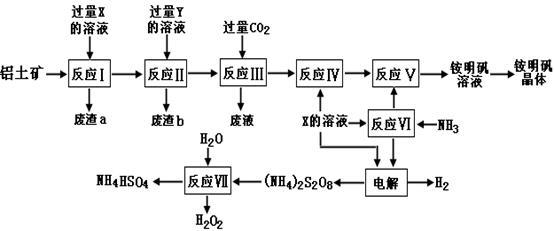
(1)废渣a、b 的成分分别是_______________、_______________。(写化学式)
(2)流程图中X的化学式为_______________。
(3)反应Ⅲ的离子方程式为________________,从铵明矾溶液中获得铵明矾晶体的操作依次为__________(填操作名称)、冷却结晶、过滤洗涤。
(4)反应Ⅶ的化学方程式为___________________。
(5)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的离子反应是 _______。(填选项字母)
| A.NH4+ + SO42— + Ba2+ + OH—= BaSO4↓ + NH3·H2O |
| B.2Al3+ + 3SO42— + 3Ba2+ + 6OH—= 3BaSO4↓ + 2Al(OH)3↓ |
| C.Al3+ + 2SO42— + 2Ba2+ + 4OH—= 2BaSO4↓ + AlO2— + 2H2O |
| D.NH4+ + Al3+ + 2SO42— + 2Ba2+ + 4OH—= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题:
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有 。
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.澄清石灰水 | D.盐酸 |
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。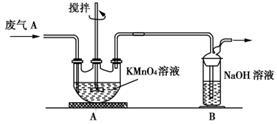
①为了保证实验成功,装置A应具有的现象是 ____,搅拌的目的是 ________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是___________ 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4•7H2O)。实验模拟制备皓矾流程如下:
①“氧化”中加入硫酸铁发生反应的离子方程式_ _。
②加入Zn粉的目的是 。
③固体A主要成分是 。
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定。乙同学拟采用图(2)所示装置来测定。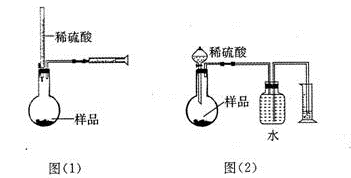
请回答下列问题:
(1)甲同学用图(1)装置来测定,在没有放样品前,检查该装置气密性的方法之一是从酸式滴定管向烧瓶中加入一定量的水,观察到 现象,证明此装量不漏气。实验时称得样品的质量为mg,酸式滴定管的起始读数为amL,终了读数为bmL,注射器测定排出的气体为c mL(已折算成标准状况),该样品中Na2C03的质量分数为(用含a、b、c、m的代数式表示)____ 。
(2)本实验选用稀H2S04而未选用稀盐酸的原因是 。
(3)乙同学观察了甲同学的实验后很受启发,并发现自己的图(2)原实验设计方案会造成误差.其原因之一可能是C02在水中溶解度较大,引起测量气体体积减小。丙同学经思考后。建议乙同学将图(2)中某部分稍作改进,就可避免此种误差,写出你的改进方案 。
(4)丁同学提出将图(2)装置中量气装置去掉,只用反应装置和天平也能较准确地测出样品中Na2C03的质量分数,请你分析丁同学方案中,除了测定样品的质量,还需测定的另两个数据是 、 。
(5)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种与上述各方法不同的实验方法 。