利用海水资源进行化工生产的部分工艺流程如下图所示:
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤。其加入药品顺序合理的是 。
a. Na2CO3、NaOH、BaCl2溶液 b.NaOH、BaCl2、Na2CO3溶液
c.NaOH、Na2CO3、BaCl2溶液 d.BaCl2、Na2CO3、NaOH溶液
(2)流程Ⅱ中,电解饱和NaCl溶液的离子方程式为 。从原子结构角度分析阴极之所以得到H2其根本原因是 。
(3)流程Ⅲ中,通过化学反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。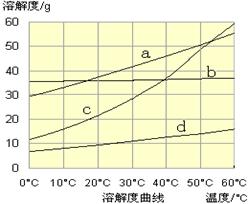
(4)流程Ⅳ中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3•10H2O。
② 对Na2CO3•10H2O脱水得到无水碳酸钠。
已知:Na2CO3·H2O(s)=Na2CO3(s)+ H2O(g) ΔH1=" +" 58.73 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=" +473.63" kJ·mol-1
如把该过程中产生的气态水液化,将释放的热量反补给该生产过程所需的能耗,若不考虑能量无效损失,则理论上生产1molNa2CO3只需耗能92.36kJ,由此得出:
H2O(g) = H2O(l) △H= 。
按要求填空:
(1)Fe2(SO4)3(写出电离方程式) .
(2)向稀硫酸溶液中滴加氢氧化钡溶液至中性(写出离子方程式) .
(3)写出实验室制取二氧化碳反应的离子方程式) .
(4)鉴别KCl溶液和K2CO3溶液的试剂是 (填名称),离子方程式为 .
(5)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 .
常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1 L溶液
(1)该溶液中除H2O的电离平衡外还存在的平衡体系是__________________。
(2)溶液中共有________种不同的微粒。
(3)这些粒子中浓度为0.01mol·L-1的是________,浓度为0.002mol·L-1的是_________。
(4)物质的量之和为0.01mol的两种微粒是_________________。
一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸。
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是______________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是____________.
(3)当c(H+)相同、体积相同时,同时加入锌,若产生相同体积的H2(相同状况),则开始时的反应速率________,反应所需时间__________。
(4)将c(H+)相同的三种酸均稀释10倍后,c(H+)由大到小的顺序是______________。
(1)25℃时,将0.1 mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。
(2)纯水中c(H+ )=5.0×10-7 mol/L,则此时纯水中的c(OH-) =_______________;若温度不变, 滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-) =_______________;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH-)=5.0×10-2 mol/L,则溶液中c(H+ )= 。
常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): .
(2)混合溶液中由水电离出的c(H+) 0.1mol/LNaOH溶液中由水电离出的c(H+)(填“>”、“<”或“=”).
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)﹣c(A﹣)= mol/L,c(OH﹣)﹣c(HA)= mol/L.
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”).
(5)将同温度下等浓度的四种盐溶液:A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl,按pH由大到小的顺序排列是: (填序号).