在化学实验探究课上,化学老师交给化学兴趣小组一包可能含有
、
(亚硝酸钠)、
(至少含有两种物质)的白色粉末,请你和同学们一起参与探究该白色粉末的主要成分.
(1)提出问题:该白色粉末的主要成分是什么?
(2)查阅资料
| 化学式 |
酸碱性 |
与稀盐酸作用 |
毒性 |
|
|
碱性 |
放出棕红色气体 |
有 |
| 中性 |
不反应 |
无 |
(3)提出猜想:
猜想Ⅰ:只含有
、
猜想Ⅱ:只含有
、
猜想Ⅲ:只含有
(4)进行探究
| 步骤 |
实验操作 |
实验现象 |
结论 |
| 步骤一 |
取少量固体样品于两支试管中,加蒸馏水溶解,向试管1滴入无色酚酞溶液,向试管
滴入过量的氧化钡溶液. |
试管1:溶液变红色 试管2:无明显现象 |
一定有 一定没有 |
| 步骤二 |
另取适量固体样品于试管中,加蒸馏水溶解,滴加硝酸银溶液 |
有白色沉淀产生 |
一定有 |
(5)通过实验,猜想
(6)写出步骤二中发生的化学方程式
(7)拓展:粗盐中常含有可溶性和不溶性杂质,粗盐提纯的基本操作步骤是溶解、
对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
| 实验内容 |
实验现象 |
分析与结论 |
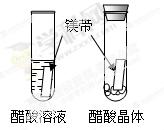 |
醋酸晶体试管内 (1),醋酸溶液试管中镁带表面冒气泡。 |
酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字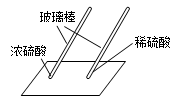 |
(2)(填“浓”或“稀”)硫酸使白纸炭化。 |
即使是同种酸,由于(3) 不同,它们的性质不完全相同。 |
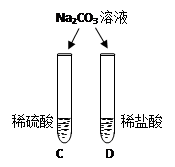 |
两试管中均产生(4) |
不同的酸具有相似的性质,这是因为酸的组成中都含有(5)(填元素符号)。 |
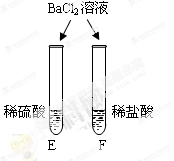 |
E试管中产生(6) , F试管中无明显现象。 |
不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为(7) 。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有(8) (填化学式)。
金属材料在国防建设中起着量要的作用,图1为歼﹣15飞机在辽宁舰上起飞
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是、。
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的共同作用的结果,工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为。
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是。
②实验二中,若出现现象,可证明铁的活动性强于铜,该反应的化学方程式为。
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg)。
①装置A中生成铁的化学方程式为,装置B中发生反应的化学方程式为。
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是。
实验室要制取一瓶纯净、干燥的二氧化碳气体,请根据以下装置回答下列问题。
(1)发生装置应选(填写装置的字母代号)。
(2)用F装置而不用E装置收集二氧化碳的原因是。
(3)若用G装置来收集二氧化碳,气体应从端进入(填a或b)。
(4)若要用C装置来干燥二氧化碳,C装置中应盛放的物质是。
(5)D装置通常用来除去二氧化碳中混有的少量氯化氢气体,请写出化学方程式。
(届上海市松江区第一学期期末试题)有一无色气体,可能是由CO、CO2、H2O(水蒸气)中的一种或几种组成。为确定其组成,小明同学按下列方案进行实验,请回答下列问题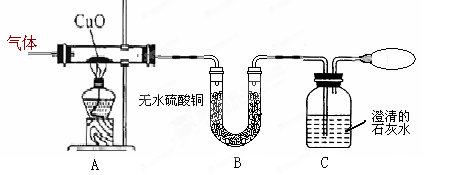
①若看见黑色氧化铜变红色,说明氧化铜发生了(15)(填“氧化”或“还原”)反应,则原无色气体中一定含有(16)。
②若看见(17)现象,则无色气体中一定不含有水蒸气。
③若看见澄清石灰水变浑浊,写出C装置中的化学反应方程式(18)。由此现象,并不能确定原无色气体中有二氧化碳,理由是(19)。
④最后用气球收集(20)(填气体化学式),保护环境。
请根据下列实验装置图回答问题.
(1)写出仪器a、b的名称:a,b。
(2)用A装置制取O2的化学方程式为,应选用的收集装置为(填装置编号),用B装置制取CO2的化学方程式为。
(3)如图F是“铁丝在氧气中燃烧”实验的改进装置.实验时,打开分夜漏斗活塞,通入干燥氧气约10秒,引燃铁丝下端火柴杆,伸入塑料瓶内,并对准玻璃管口正上方,观察到的现象是:
铁丝剧烈燃烧,。
改进后的优点是(填序号)。
①氧气无需提前制备和收集,操作更方便
②塑料瓶代替集气瓶,防止集气瓶炸裂,更安全
③装置集氧气的制取、干燥和性质验证于一体,实验更优化
(4)某兴趣小组同学将带火星的木条伸入到收集满氧气的集气瓶内,木条复燃,拿出木条,盖好集气瓶。过一会儿,再用带火星的木条伸入瓶内,木条仍然复燃.量复以上操作,直到木条不再复燃。据此现象你能得到的结论是。