2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
| A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |
(3)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生上述的两个反应:并在t秒时测定其中NOx转化率,绘得图象如图所示:
从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下: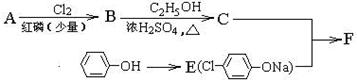
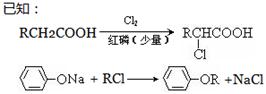 (注:R表示烃基或H原子)
(注:R表示烃基或H原子)
⑴ A为羧酸,其分子式为C4H8O2,8.8gA与足量NaHCO3溶液反应生成L CO2(标准状况,不考虑CO2溶于水)。
⑵写出符合A分子式羧酸类物质的结构简式: 。
⑶已知A→B属于取代反应,B为一卤代羧酸,其核磁共振氢谱只有两个峰,写出B→C的反应方程式:  。
。
⑷写出F的结构简式: 。
II.按如下路线,由C可合成酯类高聚物H: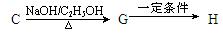
⑸写出G→H的反应方程式: 。
有以下几种物质:
| A.熔融状态的硝酸钾 | B.稀硫酸 | C.醋酸(CH3COOH) | D.BaSO4固体 |
E、酒精 F、干冰 G、铝 H、食盐水 I、石墨
在空格中填写正确的序号。
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是  。
。
(1)现有标准状况下的氮气5.6g,其体积为,含有氮分子的数目为
(2)标准状况下,2mol NH3与________g CO2的体积相等。
(3)等质量的O2和O3所含的原子个数之比是______________。
(4)实验室使用的浓盐酸的溶质的质量分数一般为36.5%,密度为1.19g/cm-3,
将升氯化氢(标准状况)通入1.00L水中 可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为。
可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为。
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
( 1)属于离子结构示意图的是 、 (填编号)。
1)属于离子结构示意图的是 、 (填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同) ,最容易失去电子的原子是 ,最容易得到电子的原子是 。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式 。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号 、 。
由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去),试回答:
(1) 反应属于取代反应(填序号),反应⑦的反应类型。
(2) 化合物的结构简式:B,C;
(3) 反应④所用试剂和条件是;
(4) 写出反应②、⑤的化学方程式:
反应②
反应⑤