化学是以实验为基础的学科。利用已学知识对下列实验进行分析并填空:
Ⅰ. 某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。
(1)甲同学设计实验所涉及的离子方程式为 、
;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应。写出该操作中主要离子方程式为 。
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到 ;
(3)根据甲乙同学的实验可得到的结论是: 。
II.(6分) 
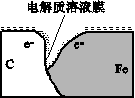
(10分)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
36.0 |
|
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。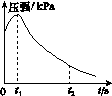
(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,补全实验步骤和结论。
实验步骤和结论
①药品用量和操作同编号①实验(多孔橡皮塞增加进、
出导管);
②通入氩气排净瓶内空气;
③。
用9mol/L的浓硫酸稀释成 0.9mol/L的稀硫酸 100mL ,回答下列问题:
(1)配制操作可分解成如下几步,以下正确的操作顺序是_____________________
A向容量瓶中注入少量蒸馏水,检查是否漏水
B用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(2)如果实验室用98%的浓硫酸(密度为1.8g·cm-3 ) 配制3.6 mol·L-1的稀硫酸250mL。计算用量简量取所需浓硫酸的体积为_____________mL。
(3)由于错误操作, 使得到的浓度数据比正确的偏大的是___________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.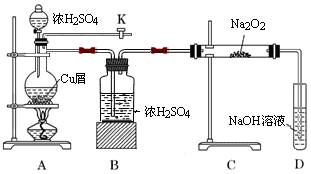
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是。
(2)B装置的作用是。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
① 停止加热后,再通入N2至整套装置冷却,其目的是。
② 取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有。
③D装置中发生反应的离子方程式是。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
| A.Cu | B. CuO | C.CuS | D.Cu2S |
某研究小组想研究炭与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速放入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①炭与浓硝酸的反应,说明浓硝酸具有性。
②反应产生的热量会使少量浓硝酸受热分解,写出该反应的化学方程式。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。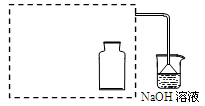
Ⅰ.制取NO2气体。
在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出这两种盐的化学式。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式。
②通过实验探究,你认为题目表格中助燃气体是什么,简述理由。
(10分)ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl
如图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体。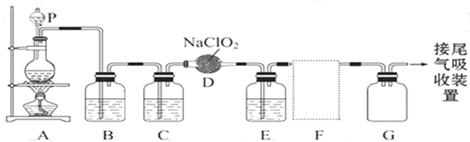
(1)仪器P的名称是_______
(2)写出装置A中烧瓶内发生反应的化学方程式:____________________________
(3)E装置中所盛试剂的作用是_____________________________
(4)F处应选用的收集装置是_______(填序号),其中与E装置导管相连的导管口是______________(填接口字母)。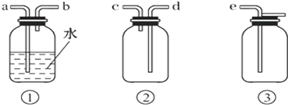
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是_________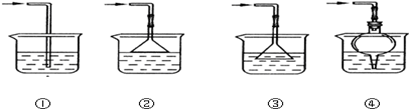
A.①② B.②③ C.③④ D.②④
(6)若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是_______(填序号)。
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(7) ClO2也可由KClO3在H2SO4溶液存在下与Na2SO3反应制得。请写出反应的离子方程式:___________________________________________________________________________。