分已知有机物甲、乙、丙有如下信息:
| |
甲 |
乙 |
丙 |
| 所含元素 |
C、H |
C、H、F |
C、H、F |
| 所含电子数 |
26 |
||
| 结构特点 |
饱和有机物 |
据此推断:
(1)甲的分子式为 ,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有 种。
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂。其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为 。下列关于乙的叙述正确的是 。
A.其分子构型为正四面体形 B.它能使溴水褪色
C.1 mol 乙最多能与1 mol F2发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为 。
(1)图甲是实验室常用的一种仪器,其名称是____;其主要用途是________;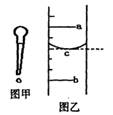
(2)小明用某规格的量筒量取一定体积的液体,液面位置如图乙,则其量得液体体积为______________(用a、b来表示)
(3)下图是某研究性小组设计的一个储气装置图。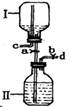
①将气体存于Ⅱ瓶中,下列说法不正确的是。
| A.打开止水夹a,b,将气体从导管d通入,可将气体储存在Ⅱ瓶中 |
| B.作为储气或取气时都无需在C处安装止水夹 |
| C.该装置主要缺陷是C导管上未装止水夹 |
| D.该装置也可用作制取氢气的发生装置 |
②要从该储好气的装置中取用气体,正确操作是:。
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。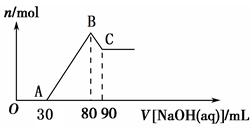
(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。
A、B、C、D、E属于短周期元素,且原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
(1)写出: AD(元素符号),乙(化学式)
(2)E元素在周期表中的位置是第周期,第族。
(3)画出B的原子结构示意图;
(4)C单质与NaOH溶液反应的离子方程式;
(5)举出C单质在工业上的一种重要用途(必须用化学方程式表示)。
下表是元素周期表的一部分,请回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|||
| 四 |
⑧ |
⑨ |
(1)在这些元素中,最活泼的非金属元素是 (元素符号),原子最外层达到稳定结构的元素是(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是(填化学式);
(3)写出③、④的最高价氧化物对应的水化物相互反应的化学方程式
;
(4)③、⑥、⑧的原子半径由大到小为﹥﹥(填元素符号),
①、⑤的最高价含氧酸酸性﹥(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式;
(6)写出工业上制备⑤单质的化学方程式。
写出下列反应的热化学方程式:
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ.