已知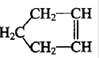 可简写为
可简写为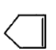
降冰片烯的分子结构可表示为: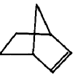
(1)降冰片烯属于__________。
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为____。
(4)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为______________。
以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是(填序号),写出反应⑥的化学方程式______。
X、Y、Z三种短周期元素,原子序数依次增大,X的最外层电子数为次外层电子数的2倍,Y原子核外共有8个电子,Z是它所属周期中金属性最强的元素,可以和Y形成化合物Z2Y和Z2Y2。则:
(1)X的元素符号是,Y的元素名称是,Z的离子结构示意图为;
(2)Y元素在周期表第周期族
(3)化合物Z2Y的电子式为。
(4)Z2Y2和XY2反应的化学方程式是:
在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是___ ____。
(2)写出有关反应的化学方程式: ____ ___ ,
该反应属_______反应(填基本反应类型)。
(3)实验中观察到的现象有__ _____ 、___ ____且反应混合物成糊状,反应混合物呈糊状的原因是____ ___ 。
(4)通过___ _现象,说明该反应为_______热反应,这是由于反应物的总能量__ ___ _
生成物的总能量(填“高”或“低”)
(9分)下表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题。
(1) 元素④的原子结构示意图是。
(2) 元素③与⑥形成的化合物中的化学键类型为。元素①与⑤形成的化合物的电子式为。
(3) 在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式);这三种元素最高价氧化物对应水化物中碱性最强的是(填写化学式);
(4)元素⑤、⑥、⑦的单质氧化性依次(填写“增强”或“减弱”),它们的气态氢化物中稳定性最弱的是(化学式)。
(5)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方。写出该反应的化学方程式。