(12分) 实验室以含有Ca2+、Mg2+、Cl-、SO、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
(1)操作Ⅰ使用的试剂是 ,所用主要仪器的名称是 。
(2)加入溶液W的目的是_____________________________________。
用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是 。酸化溶液Z时,使用的试剂为 。
| |
开始沉淀时的pH |
沉淀完全时的pH |
| Mg2+ |
9.6 |
11.0 |
| Ca2+ |
12.2 |
c(OH―)=1.8 mol·L-1 |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是 。

有机化合物A的相对分子质量为153,A有如下的性质:
Ⅰ.取A的溶液少许,加入NaHCO3溶液,有气体放出。
Ⅱ.另取A的溶液,向其中加入足量的NaOH溶液,加热反应一段时间后,再加入过量的
HNO3酸化的AgNO3溶液,有淡黄色沉淀生成。
A有如下的转化: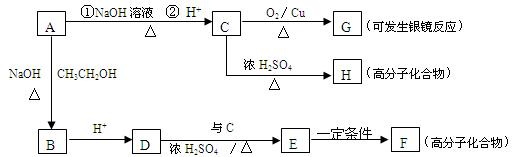
请填空:
(1)A物质的结构简式。
(2)C→G的反应类型;A→B的反应类型。
(3)写出与C具有相同官能团的同分异构体的结构简式;
G与过量的银氨溶液反应,每生成2.16克Ag,消耗G的物质的量是mol。
(4)写出下列反应的化学方程式:
D→E。
C→H。
一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有____________;②最终结果可知原气体中______与_______气体的体积比为_______。
某学生设计氨催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成。可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO。可供选择的液体药品有:H2O2、浓盐酸、水。可供选择的仪器有: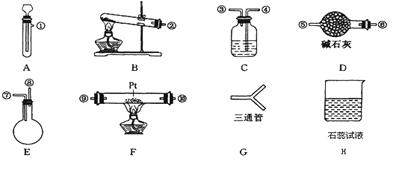
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置均允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应应在装置中进行。
(2)制取NH3的装置最好选择,其化学反应方程式为;为快速制取O2的装置最好选择,其化学反应方程式为。
(3)各仪器按气流方向连接的正确顺序为:
A、B→G→→ F →→→ H。(按装置先后排列顺序补充完整)
(4)装置C的作用是。
( 5 ) 如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中
氨气是否集满(简述操作、现象和结论)?
(6)装置H中溶液显红色,其原因是
(7)请据以上实验事实设计一个实验来检验一份白色药品是铵盐,写出其正确
的实验操作步骤
如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。试回答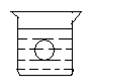
⑴此实验中,观察到的现象有:
①,②。
⑵写出实验过程中反应的离子方程式为。
按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①NO(NO2)②NH3(H2O)
(2)实验室配制100mL0.5mol·L‑1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末g。[来
②配制时应选用的仪器有500mL容量瓶,托盘天平、烧杯、药匙、。
③若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量至刻度线 |
| B.没有将洗涤液转入容量瓶 |
| C.容量瓶洗涤后内壁有水珠而未作干燥处理 |
| D.定容时府视刻度线 |