下列有关热化学方程式的表示及说法正确的是( )
| A.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| B.已知I2(g)+H2(g)=2HI(g) △H1;I2(s)+H2(g)=2HI(g) △H2; 则△H1<△H2 |
| C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.已知H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量 |
下列各组离子在对应溶液中可能大量存在的是
| A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4- |
| B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl- |
| C.含有大量ClO-的溶液:H+、I-、SO42-、Cl- |
| D.pH=12的溶液:K+、Cl-、SO32-、SiO32- |
下列装置能达到实验目的的是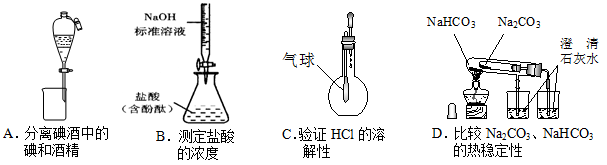
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO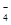 … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO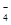 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e → SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e → 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |