(共10分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。 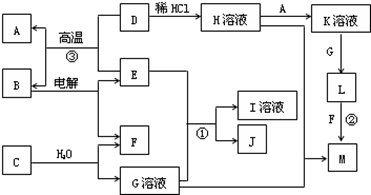
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式 ;
(4)写出②、③反应的离子方程式② ,③ 。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题: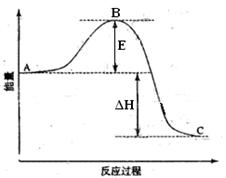
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H=KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=mol·L-1·min-1、υ(SO3)=mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求计算过程)。
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有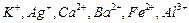 ,
, 阴离子有
阴离子有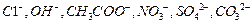 ,现将它们分别配成
,现将它们分别配成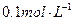 的溶液,进行如下实验:
的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加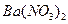 溶液,无明显现象;
溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
;
(2)E溶液是,判断依据是
;
(3)写出下列四种化合物的化学式:A、C、
D、F.
有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种。
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式:;
(2)试写出工业上用电解方法冶炼D单质的化学方程式;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目:;
(4)写出实验室制取单质E的化学方程式:。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
某溶液中可能含有Na+、K+、Mg2+、I—、SO32—、SO42—等离子中的全部或其中的几种。现分别进行以下实验操作:①用洁净的铂丝蘸取溶液在无色火焰上灼烧,焰色呈黄色;②取原溶液,滴加少量溴水,振荡后溶液仍为无色。③取原溶液,加入盐酸酸化的Ba(NO3)2溶液后,产生白色沉淀。
(1)原溶液中一定存在的离子是,一定不存在的离子是。
(2)上述①~③,的操作中,是错误的,应改为,以便确定离子的存在。
(3)为确定离子是否存在,应补充的实验是①②。