利用从冬青中提取的有机物合成结肠炎药物及其它化学品,合成路线如下:

根据上述信息回答:
(1)不与溶液反应,中官能团的名称是。的反应类型是。
(2)写出生成和的化学反应方程式。
(3)的同分异构体和是重要的医药中间体,在浓硫酸的作用下和分别生成 ,鉴别和的试剂为。
,鉴别和的试剂为。
(4)的另一种同分异构体用于合成高分子材料可由 制得,写出在浓硫酸作用下生成的聚合物的结构简式:。
制得,写出在浓硫酸作用下生成的聚合物的结构简式:。
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为,其电极均由石墨材料做成,则电解时不断消耗的电极是(填“阴极”或“阳极”),冰晶石的作用为。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为,正极附近溶液的pH(填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s)△H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s)△H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g)△H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H=。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,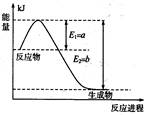
请写出合成氨的热化学反应方程式:(ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为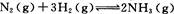 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式:。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示
铅蓄电池的总反应方程式为,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为,MnO2的理论产量为g。
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为;
(2)探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)=mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。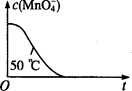
[化学—选修:化学与技术]三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
(1)氯化水解法生产三氯氧磷的化学方程式为。
(2)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(选填字母),滴定终点的现象为。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉②实验过程中加入硝基苯的目的是,如无此操作所测Cl元素含量将会(填“偏大”、“偏小”或“不变”)
(3)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是。
②下图是不同条件对磷的沉淀回收率的影响图像。
处理该厂废水最合适的工艺条件为(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(15分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g)△H= 574 kJ·moll
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g)△H= 1160 kJ·moll
③H2O(l)=H2O(g)△H=+44kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式___。
II、开发新能源和三废处理都是可持续发展的重要方面。CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
(1)M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=。
(2)若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为;P1P2 (填“>” 或“<” 或“=”)
III、用MnO2制KMnO4的工艺流程如下图:电解池中两极材料均为碳棒,在中性或酸性溶液中K2MnO4发生歧化反应而变成MnO2和KMnO4。
(1)写出240℃熔融时发生反应的化学方程式;投料时必须满足n(KOH):n(MnO2)。
(2)阳极的电极反应式为。
(3)B物质是(填化学式),可以循环使用的物质是(填化学式)。
有M、N两种溶液,经测定这两种溶液中大量存在下列12种离子:Al3+、Cl-、Na+、K+、NO3—、OH-、Fe2+、AlO2—、CO32—、NH4+、SO42—、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 |
结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 |
|
| ② |
确定M溶液中含有Na+,不含K+ |
| ③用pH试纸检测M溶液,pH试纸呈蓝色 |
(2)根据(1)中的实验回答:
NO3—存在于________溶液中,理由是;
Cl-存在于________溶液中,理由是;
(3)根据(1)中的实验确定,M溶液中含有的离子为。