某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 |
H2C2O4溶液 |
KMnO4溶液 |
硫酸溶液 |
温度/℃ |
||
| |
浓度 (mol/L) |
体积 (mL) |
浓度 (mol/L) |
体积 (mL) |
|
|
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
50 |
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
、、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是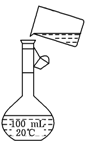
________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2(填>、=或<)
2L,原因
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质: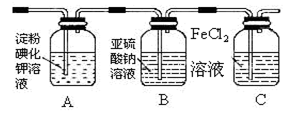

①通入氯气后,A中的现象是,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是。
(2)操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是。
(3)操作IV的顺序依次为:、冷却结晶、。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b. 量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100
量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100 0mol/L
0mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②判断此滴定实验达到终点的方法是。
③计算上述样品中FeSO4·7H2O的质量分数为(用小数表示,保留三位小数)。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
⑴稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为________________________________________________________。
某同学未加入氧化剂,而是 设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
⑵某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下: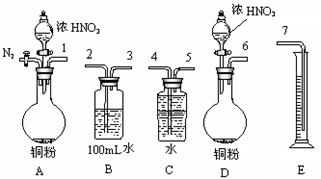
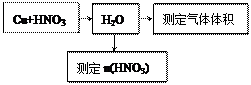 |
①若要测定NO的体积,从上图所示的装置中,你认为应选用装置进行Cu与浓硝酸反应实验,选用的理由是。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为L。
工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
⑴若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:▲。
⑵为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为▲。
⑶硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为▲;
②若V=35,试计算混合物中CuS的质量分数。
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下: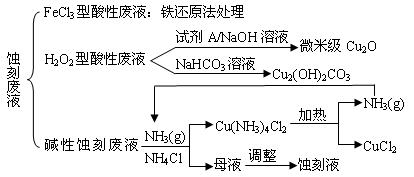
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 ▲ 、 ▲ 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
▲ 。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 ▲ (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 ▲ 。
⑸ 碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 ▲ 。