(12分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式_________________。
(2)甲和乙两个水浴作用不相同,乙的作用是___________________。集气瓶中收集到的气体的主要成分是_____________________。
(3)若试管a中收集到的液体用紫色石蕊试纸,试纸显红色,说明液体中还有____________。要除去该物质,可先在混合液中加入_________(填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
然后再通过___________(填实验操作名称)即可除去。
(4)实验一段时间后,将试管a中的液体取出,加入足量的银氨溶液,再放入甲烧杯中,很快出现明显的现象。写出该反应的化学方程式: ;反应类型为
(10 分)为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2的氧化性
将光亮的铁丝伸入Cu(NO3)2溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
| 操作 |
反应或现象 |
结论 |
| 取少量除尽 Cu2+后的溶液于试管中,加入① 溶液,振荡 |
现象② |
存在 Fe3+ |
| 取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6] 溶液,振荡 |
离子方程式③ |
存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在下图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。
(2)装置B 的作用是 。
(3)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置
(4)下图为Cu(NO3)2样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
Cu(NO3)2加热到200℃的化学方程式为 ,继续高温至1000℃生成 (填化学式)固体。
配制480 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、_____、____等。
(2)计算、称量:需称量NaOH固体的质量为________。
(3)溶解、冷却,该步实验中需要使用玻璃棒,作用是___________________。
(4)转移、洗涤。洗涤烧杯2~3次是为了_________________。
(5)定容、摇匀。定容的具体操作是____________________。
(6)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,偏低的是___ (填字母序号)
| A.容量瓶洗净后未烘干; |
| B.在溶解过程中有少量液体溅出烧杯外 |
| C.定容时俯视刻度线; |
| D.将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 |
E.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
实验室有NH4HCO3和NaHSO3的混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。(已知酸性KMnO4被SO2还原的反应原理:SO2+MnO4-+H2O→SO42-+Mn2++H+)回答以下问题:
(1)化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)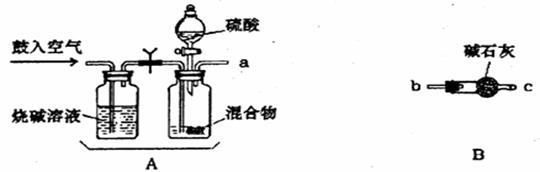
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b…)
a→ →_______→______→______→f→g→_______→_______。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是_____________;加酸后A装置再次鼓入空气的作用是 。
(3)E装置的作用是 。
(4)实验中若C瓶中溶液褪色,则测定结果可能会偏__________。(填高或低)
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为______。
现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示: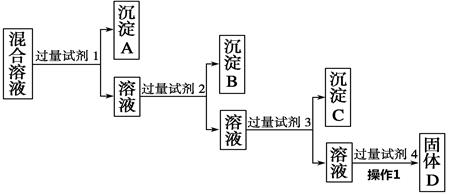
(1)写出下列物质的化学式:试剂1________,试剂2________,试剂4________,沉淀C 。
(2)加入过量试剂3的目的是__________________。
(3)在加入试剂4后,获得固体D的实验操作1分别是 、 、过滤(填操作名称)。
某化学学习小组设计下图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为____________mol。
(2)装置B的作用______________。
(3)装置C的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是__________________、____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________________。
(5)请用化学方程式说明装置F的作用:_____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:_________________。