石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平。请回答下列问题。
(1)下列物质中,不可以通过乙烯发生加成反应得到的是 (填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
(2)工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是 。
(3)已知 2CH3CHO+O2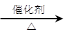 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。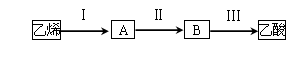
反应II的化学方程式为 。
(4) 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物的质量为30g。则该有机物的分子式为 又知此有机物不具有弱酸性,不能与金属钠反应,能与碱溶液反应,试写出其结构简式
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①3—4min之间,化学平衡向_______反应方向移动(填“正”或“逆”)。
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。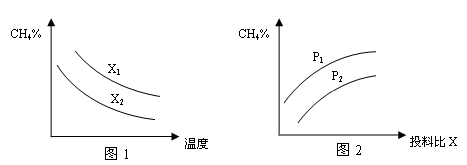
①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为____。
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
①试剂Y的名称;物质X最好是(填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·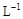 ,则加入Cl2气和物质X使溶液的pH在范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20、lg5=0.7)
,则加入Cl2气和物质X使溶液的pH在范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20、lg5=0.7)
(本题共13分)
有机物A1和A2分别和浓H2SO4在一定温度下共热都生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下:([O]表示氧化反应)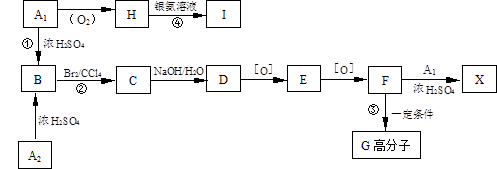
52、反应①属于反应,反应②属于反应
53、写出A2和X两种物质的结构简式:
A2X
54、书写化学方程式:
③
④
55、化合物E有多种同分异构体,请写出其中属于酯类且具有两个对位侧链的同分异构体的结构简式:
(本题共9分)
某芳香族化合物H(C11H12O4)是有机合成工业的一种重要的中间产物,其合成路线如下。已知2molC分子可缩合生成1mol六元环化合物分子。F常温下是气体,水溶液具有很好的防腐杀菌效果,且能与新制氢氧化铜反应。请回答下列问题: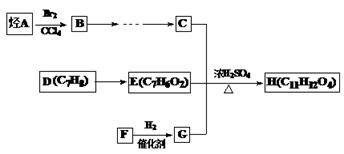
47、F的电子式为, A的结构简式
48、B转化为C的条件是
| A.水解、酸化、氧化、还原 | B.氧化、水解、酸化、还原 |
| C.水解、酸化、还原、氧化 | D.氧化、酸化、水解、还原 |
49、以C为原料可合成可降解塑料,试写出其化学方程式
50、H与氢氧化钠溶液反应的化学方程式
51、H的同分异构体有多种,请写出符合下列条件的同分异构体的结构简式。(写一种即可)
①苯环上只有两个取代基,苯环上的一氯取代物只有两种
②1mol的H与足量的NaHCO3溶液反应,生成2molCO2
(本题共12分)
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。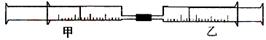
| 实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
| 1 |
40 mL HCl |
40 mLNH3 |
产生白烟 |
| 2 |
40 mL Cl2 |
10mL 水 |
剩余气体为20mL |
| 3 |
30 mL NO |
15 mL O2 |
|
| 4 |
20 mL AlCl3溶液 |
10 mL NaOH溶液 |
生成白色沉淀,后消失 |
41.如果实验1甲针筒内改装30 mL Cl2 ,乙针筒内仍为40 mLNH3,实验时,甲针筒内也有白烟产生。写出有关反应的化学方程式 。
42.由实验2可知,常温常压下氯气在水中的溶解度为 。
43.实验3 反应后甲针筒内气体的体积为 。
44.实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
45.将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。
46.有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
(1)A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
(2)已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。