乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.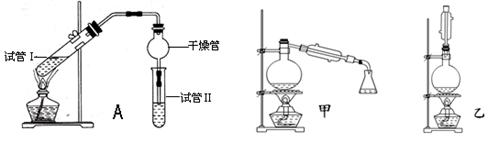
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
有机层的厚度/cm |
| A |
2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2mL乙醇、1mL乙酸 |
0.1 |
|
| C |
2mL乙醇、1mL乙酸、 3mL 2mol•L-1H2SO4 |
0.6 |
|
| D |
2mL乙醇、1mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是 mL和 mol•L-1.
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 .
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.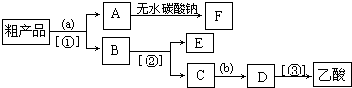
①试剂a是 ;分离方法②是 ,分离方法③是 .分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是 .
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
9.2 g氮的氧化物N2Ox中含氮原子0.2 mol,则N2Ox的摩尔质量为;x=,
(10分) Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S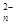
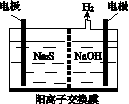
①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
Ⅱ.用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
FeCl3与H2S反应的离子方程式为________________________________________________。
电解池中H+在阴极放电产生H2,阳极的电极反应为___________________________________。
综合分析的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②。
(7分)(1)实验测得:在室温下1L水中只有10-7mol的水电离,列式计算水的电离平衡常数KH2O;
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示,则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由。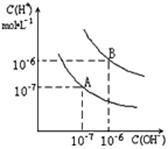
(12分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。( ,计算结果保留小数点后1位)
,计算结果保留小数点后1位)
(11分)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是 ________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为____。